题目内容
50克氯酸钾和8.6二氧化锰混合加热一段时间后冷却,称得剩余固体质量为49克,计算
(1)反应生成氧气 克;
(2)剩余固体中氯酸钾的质量分数.
(1)反应生成氧气
(2)剩余固体中氯酸钾的质量分数.
考点:根据化学反应方程式的计算
专题:有关化学方程式的计算
分析:根据质量守恒定律,生成氧气的质量=反应前物质质量总和-反应后物质质量总和;利用氯酸钾分解的化学方程式和生成氧气的质量,列出比例式,就可计算出该样品中实际参加反应的氯酸钾的质量,进而求出剩余固体中氯酸钾的质量分数.
解答:解:(1)根据质量守恒定律,生成氧气的质量=50g+8.6g-49g=9.6g;
(2)设该样品中实际参加反应的氯酸钾的质量为x,
2KClO3
2KCl+3O2↑
245 96
x 9.6g
=
解之得:x=24.5g
剩余固体中氯酸钾的质量分数为:
×100%=52%
答:剩余固体中氯酸钾的质量分数为52%
(2)设该样品中实际参加反应的氯酸钾的质量为x,
2KClO3
| ||
| △ |
245 96
x 9.6g
| 245 |
| 96 |
| x |
| 9.6g |
解之得:x=24.5g
剩余固体中氯酸钾的质量分数为:
| 50g-24.5g |
| 49g |
答:剩余固体中氯酸钾的质量分数为52%
点评:本题主要考查学生利用化学方程式进行计算的能力.利用质量守恒定律,计算出生成气体的质量,再结合化学方程式,就可以解决要求的问题.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
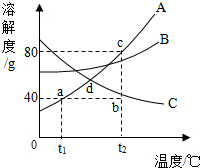 如图是常见固体物质A、B的溶解度曲线,下列说法不正确的是( )
如图是常见固体物质A、B的溶解度曲线,下列说法不正确的是( )| A、t1℃时,A物质的溶解度为40g |
| B、将140 g A物质的b点溶液变饱和,可以加入40 g A物质或将温度降至t1℃ |
| C、t2℃时A、B两种物质饱和溶液的溶质质量分数A>B |
| D、若将d点温度下A、B的饱和溶液降温至t1℃,析出的晶体A>B |
 小明探究二氧化碳的性质做了如下两个实验:
小明探究二氧化碳的性质做了如下两个实验: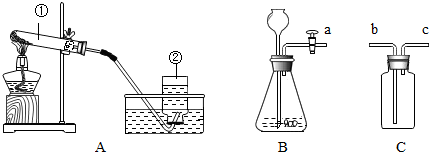


 化学与生活息息相关,请用化学知识回答下列问题.
化学与生活息息相关,请用化学知识回答下列问题.