题目内容
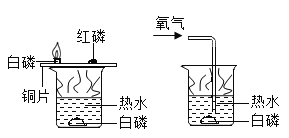
【题目】同学们学习了二氧化碳的实验室制法,在课后同学们设计了如图几个装置,请你分析以下,下列装置在制取二氧化碳时不能使反应随时发生或停止的装置是( )
A.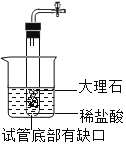 B.
B.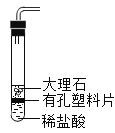 C.
C.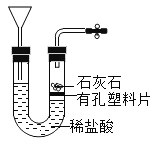 D.
D.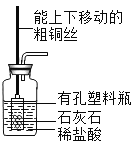
【答案】B
【解析】
A、试管底部有缺口,只要放入烧杯中,稀盐酸可以随时进入试管中产生气体,不用时可以随时移出试管,可以控制反应的进行。A正确;
B、试管中虽然有有孔塑料片,但是稀盐酸总是没过大理石,所以无法控制反应的进行。B错误;
C、石灰石在有孔塑料片上,需要气体时,打开弹簧夹,U型管的右侧压强减小,稀盐酸就会浸没石灰石产生气体。不需要气体时,关闭弹簧夹,U型管右侧压强增大,稀盐酸被压到塑料片一下,无法接触,从而控制反应的进行。C正确;
D、粗铜丝可以带动内部的装置上下移动,从而可以控制小装置内部的石灰石是否和集气瓶中的稀盐酸接触,从而控制反应的进行。D正确。
故选B。

 阅读快车系列答案
阅读快车系列答案【题目】研究性学习小组选择“过氧化氢分解生成氧气的快慢与什么因素有关”的课题进行探究,以下是他们探究的主要过程。
(提出猜想)过氧化氢分解生成氧气的快慢与催化剂的种类有关。
(实验方案)常温下,取两份体积相同、浓度相同的过氧化氢溶液,分解加入二氧化锰和红砖粉末,测定各收集一瓶(体积相同)氧气所需要的时间。
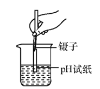
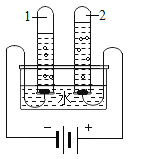
(进行实验)实验装置如图所示,组装好实验装置后,首先要_______________,再将分液漏斗中的液体加入锥形瓶中,立即收集一瓶气体,此实验中宜采用的收集气体的方法是____________。
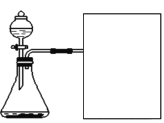
(实验记录)
试验编号 | ① | ② |
反应物 | 5%过氧化氢溶液50g | 5%过氧化氢溶液50g |
催化剂 | 红砖粉末 | 1g二氧化锰 |
收集气体所需时间 | 165s | 46s |
实验①中加入红砖粉末的质量是__________ g。
(得出结论)该探究过程得出的结论是____________________。
(反思)过氧化氢在常温下分解缓慢,加入二氧化锰或红砖粉末后分解速率明显加快,若要证明二氧化锰和红砖粉末是否为该反应的催化剂,还需要增加实验来验证它们在化学反应前后的 __________和________是否改变。
【题目】实验室常用下列装置制取气体,请你根据所学知识回答下列问题:
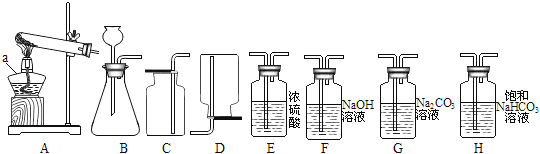
(1)仪器a的名称是_____。
(2)实验室用氯酸钾制取氧气时,选用的发生装置是_____(填字母序号)。若改用下图装置收集氧气,则气体应从______端进(填“a”或“b”)。
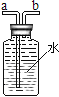
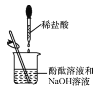
(3)实验小组同学取一定浓度的盐酸和石灰石反应制取气体,反应的化学方程式为____;将生成的气体通入澄清石灰水中,未见变浑浊。为探究其原因,小组同学讨论后作出如下猜想:
(作出猜想)A 石灰水已经完全变质 B 气体中有挥发出来的HCl气体
(实验探究)小组同学设计了如下实验来验证。请你帮助完成实验,填写以下表格:
实验步骤 | 实验现象 | 实验结论 |
①取少量石灰水于试管中,并向试管中滴加几滴无色酚酞试液,振荡 | ____ | 猜想A不成立 |
②将生成的气体通入_____溶液中 | 产生白色沉淀 | 气体中有HCl 猜想B成立 |
(查阅资料)碳酸钠溶液中通入二氧化碳发生反应:Na2CO3+H2O+CO2=2NaHCO3
(拓展延伸)如果用上述原料制取一瓶干燥纯净的二氧化碳气体,所选仪器的连接顺序为B→(_____)→(_____)→C(填字母序号)。