题目内容
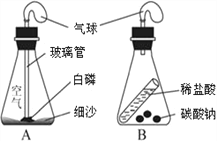
【题目】某中学兴趣小组的同学利用如图所示的装置,对质量守恒定律进行了探究。
(1)I、提出假设: 红磷在空气中燃烧符合质量守恒定律吗?
II、设计实验:展鹏同学将一定质量的白磷放入装置内,称得A装置的总质量为203.1g,然后将烧红的玻璃管迅速伸入瓶内,并立即塞紧瓶塞。
III、观察现象:观察到瓶内白磷燃烧的现象是____________________,装置冷却后,再次称得A装置总质量为203.1g。
IV、总结:①该反应符合质量守恒定律。
②锥形瓶中细沙的作用是__________________________________________
③瓶内发生的化学反应方程式为____________________________________
(2)张林同学认为碳酸钠与稀盐酸反应也符合质量守恒定律。于是他设计了B装置,称出反应前药品及装置的总质量为300.4g。反应结束后,他与展鹏同学的实验进行了以下对比:
① 冷却至室温,气球仍鼓胀的是________(选填“A”或“B”或“A和B”)。
② 反应后药品及装置的总质量为300.0g,你认为张林同学实验所测数据减少的原因可能是___________(填序号)。
A.稀盐酸不足 B.碳酸钠中含有不与稀盐酸反应的杂质
C.装置气密性不够好 D.气球受到空气浮力的影响
(3)小结:由质量守恒定律可知,化学反应前后一定不变的是________(填序号)
①原子种类 ②原子数目 ③分子种类 ④分子数目
⑤元素种类 ⑥物质种类
【答案】 产生大量的白烟 防止高温的生成物落下使瓶底炸裂 4P + 5O2 ![]() 2P2O5 B CD ①②⑤
2P2O5 B CD ①②⑤

 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案【题目】某化学兴趣小组的同学采用了下图所示装置测定空气中氧气含量。
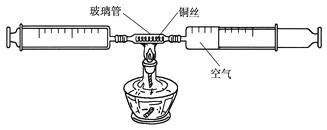
在由两个注射器组成的密闭系统中留有25mL空气,给装有细铜丝的玻璃管加热,同时缓慢推动两个注射器活塞,至玻璃管内的铜丝在较长时间内无进一步变化时停止加热,待冷却至室温,将气体全部推至一个注射器内,观察密闭系统内空气体积变化。
(1)在实验加热过程中,交替缓慢推动两个注射器活塞的目的是__________________;
(2)写出该实验过程中玻璃管内的现象为_______________________________,写出该反应的符号表达式________________________________;
(3)小强实验操作均正确,测得实验结果如下:
反应前注射器内气体总体积 | 反应后注射器内气体总体积 |
25mL | 20mL |
该实验得出的结论为 ____________________________________;
小红同学实验误差较大,请你帮她分析造成误差的原因_____________(写出一条即可)。