题目内容
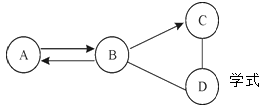
【题目】实验室有一瓶标签被腐蚀的盐酸,小丽为了测定溶液中溶质的质量分数,在烧杯中配制了8g 10%的NaOH溶液。然后往烧杯中滴加该盐酸。反应过程中溶液的pH与滴入盐酸的质量关系如图所示。请回答下列问题: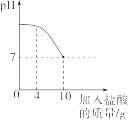
(1)配制了8g 10%的NaOH溶液,需要水的质量为;
(2)计算该盐酸的溶质质量分数;(写出计算过程)
(3)当滴入4g盐酸时,烧杯内溶液中钠元素的质量为。
【答案】
(1)7.2g
(2)解:设10g稀盐酸中氯化氢的质量为x。
NaOH+ | HCl=NaCl+H2O |
40 | 36.5 |
8g×10% | x |
![]()
x=0.73g
该盐酸的溶质质量分数为x=×100%=7.3%。
答:该盐酸的溶质质量分数为7.3%。
(3)0.46g
【解析】(1)溶剂的质量等于溶液质量乘以溶剂质量分数,8![]() (1-10%)=7.2g
(1-10%)=7.2g
(2)解:设10g稀盐酸中氯化氢的质量为x。
NaOH+ | HCl=NaCl+H2O |
40 | 36.5 |
8g×10% | x |
![]()
x=0.73g
该盐酸的溶质质量分数为x=×100%=7.3%。
答:该盐酸的溶质质量分数为7.3%。
(3)烧杯中钠元素的质量=8×10%×23/40=0.46g
(1)根据溶液质量与溶质质量分数的关系可解答
(2)根据加入稀盐酸的量可以计算盐酸的质量分数,钠元素的质量与盐酸的质量没有关系,就是氢氧化钠中的钠元素质量

 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案【题目】研究和控制化学反应条件有重要意义。
(1)同学们想探究双氧水的溶质质量分数对反应速率的影响。在其他条件相同的情况下进行了三次实验,记录各收集一瓶相同体积氧气所需要的时间。
实验 | 30%双氧水的质量(g) | 加入的谁的体积(mL) | 二氧化锰质量 | 收集时间(s) |
① | 10 | 40 | 5 | 200 |
② | 20 | 30 | 5 | 100 |
③ | 30 | 20 | 67 |
①实验时,取用二氧化锰的仪器是(填仪器名称)。
②如下图所示,发生装置应选用(填编号,下同),此题中气体收集装置应采用的是。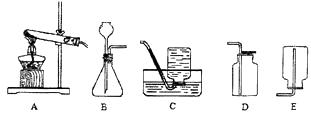
③实验3中,加入的二氧化锰质量为g。
④相同条件下,实验3产生氧气的速率最快,说明。
⑤第三次实验结束后,测得容器中全部剩余物的总质量为50.8g,则该实验生成氧气的质量是g。
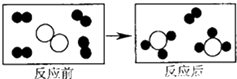
(2)二氧化碳与水反应,在常温下进行的化学方程式为 , 在叶绿素、光照的条件下发生光合作用生成葡萄糖 (C6H12O6)和氧气的化学方程式为 , 反应物相同,但产物不同。说明不同,产物不同。