题目内容
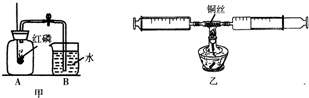
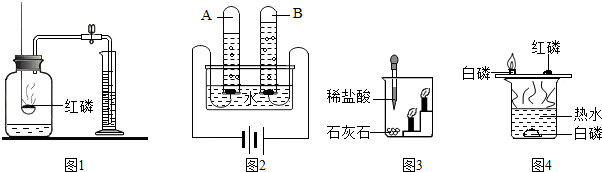
(1)测定空气中氧气的体积分数可以采用图甲乙两种装置,甲装置实验过程中,红磷燃烧产生大量白烟,当温度降到室温,打开止水夹,会观察到______现象.乙装置可视为甲的改进装置,乙装置与甲装置相比较,优点在于______(任答一点).
(2)乙装置实验完后,变黑的铜丝可用稀硫酸处理得到硫酸铜.工业上制备硫酸铜通常有两种方案.
方案一:铜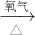 氧化铜
氧化铜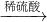 硫酸铜
硫酸铜
方案二:铜 硫酸铜[Cu+2H2SO4(浓)
硫酸铜[Cu+2H2SO4(浓) CuSO4+SO2↑+2H20]
CuSO4+SO2↑+2H20]
其中方案______更适合工业生产,主要原因是______(任答一点).
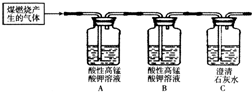
(3)方案二产生的S02具有和C02类似的性质,都能使澄清石灰水变浑浊,除此之外,SO2还能被酸性高锰酸钾溶液吸收,使高锰酸钾溶液颜色由紫色变为无色.某化学兴趣小组为探究煤燃烧的气体产物,将煤燃烧产生的气体通入澄清石灰水,观察到石灰水变浑浊.
根据现象,猜想一:煤燃烧产生的气体是C02;
猜想二:煤燃烧产生的气体是S02;
猜想三:煤燃烧产生的气体是______.为了验证此气体成分,该小组设计了如下实验,其中B装置的作用是______;当观察到______现象,证明猜想三成立.
解:
(1)空气中氧气约占空气总体积的 ,红磷燃烧消耗瓶内氧气,所以瓶内气压减小,打开止水夹,会观察到瓶内,约占A瓶容积的
,红磷燃烧消耗瓶内氧气,所以瓶内气压减小,打开止水夹,会观察到瓶内,约占A瓶容积的 ;乙装置刻度更精细,测量更精确;且红磷燃烧生成大量白烟,而铜丝反应生成氧化铜黑色固体,所以可以减少污染;
;乙装置刻度更精细,测量更精确;且红磷燃烧生成大量白烟,而铜丝反应生成氧化铜黑色固体,所以可以减少污染;
故答案为:
水进入到A瓶,约占A瓶容积的 ; 测量更为精确或减少污染;
; 测量更为精确或减少污染;
(2)对比两个实验方案,方案一铜与氧气反应生成氧化铜,氧化铜与稀硫酸反应生成硫酸铜和水,与二相比,无污染大气的二氧化硫生成,更环保;
方案一反应方程式是2Cu+O2 2CuO,CuO+H2SO4═CuSO4+H20,由此可知:Cu~H2SO4,方案二中 Cu~2H2SO4,对比可以发现方案一硫酸的利用率更高;
2CuO,CuO+H2SO4═CuSO4+H20,由此可知:Cu~H2SO4,方案二中 Cu~2H2SO4,对比可以发现方案一硫酸的利用率更高;
故答案为:
一; 无污染大气的SO2产生或H2SO4利用率更高;
(3)结合猜想一和猜想二,煤燃烧还可能产生SO2和CO2的混合气体;由题意可知:二氧化硫能被酸性高锰酸钾溶液吸收,使高锰酸钾溶液颜色由紫色变为无色,所以A装置的作用是检验是否含有二氧化硫,B装置是检验SO2是否被除尽,而C装置是用来检验是否含有二氧化碳;若猜想三正确,则A瓶溶液褪色,B瓶溶液不褪色,C瓶溶液变浑浊;
故答案为:
SO2和CO2的混合气体; 检验SO2是否被除尽;
A瓶溶液褪色,B瓶溶液不褪色,C瓶溶液出现白色沉淀或变浑浊.
分析:(1)本题考查的是空气中氧气含量测定,可以从空气中氧气含量及两套装置的特点分析解答;
(2)比较两个实验方案优劣,可以从实验是否简便、环保、节约能源、原料利用率等方面分析解答;
(3)分析题目所给信息,明确各装置的作用,了解实验探究原理,从而得出结论.
点评:本题是一道综合性较强的实验题,既有实验探究,又有对方案的评价等知识,要根据题意结合所学知识细心分析才能正确解答.
(1)空气中氧气约占空气总体积的
 ,红磷燃烧消耗瓶内氧气,所以瓶内气压减小,打开止水夹,会观察到瓶内,约占A瓶容积的
,红磷燃烧消耗瓶内氧气,所以瓶内气压减小,打开止水夹,会观察到瓶内,约占A瓶容积的 ;乙装置刻度更精细,测量更精确;且红磷燃烧生成大量白烟,而铜丝反应生成氧化铜黑色固体,所以可以减少污染;
;乙装置刻度更精细,测量更精确;且红磷燃烧生成大量白烟,而铜丝反应生成氧化铜黑色固体,所以可以减少污染;故答案为:
水进入到A瓶,约占A瓶容积的
 ; 测量更为精确或减少污染;
; 测量更为精确或减少污染;(2)对比两个实验方案,方案一铜与氧气反应生成氧化铜,氧化铜与稀硫酸反应生成硫酸铜和水,与二相比,无污染大气的二氧化硫生成,更环保;
方案一反应方程式是2Cu+O2
 2CuO,CuO+H2SO4═CuSO4+H20,由此可知:Cu~H2SO4,方案二中 Cu~2H2SO4,对比可以发现方案一硫酸的利用率更高;
2CuO,CuO+H2SO4═CuSO4+H20,由此可知:Cu~H2SO4,方案二中 Cu~2H2SO4,对比可以发现方案一硫酸的利用率更高;故答案为:
一; 无污染大气的SO2产生或H2SO4利用率更高;
(3)结合猜想一和猜想二,煤燃烧还可能产生SO2和CO2的混合气体;由题意可知:二氧化硫能被酸性高锰酸钾溶液吸收,使高锰酸钾溶液颜色由紫色变为无色,所以A装置的作用是检验是否含有二氧化硫,B装置是检验SO2是否被除尽,而C装置是用来检验是否含有二氧化碳;若猜想三正确,则A瓶溶液褪色,B瓶溶液不褪色,C瓶溶液变浑浊;
故答案为:
SO2和CO2的混合气体; 检验SO2是否被除尽;
A瓶溶液褪色,B瓶溶液不褪色,C瓶溶液出现白色沉淀或变浑浊.
分析:(1)本题考查的是空气中氧气含量测定,可以从空气中氧气含量及两套装置的特点分析解答;
(2)比较两个实验方案优劣,可以从实验是否简便、环保、节约能源、原料利用率等方面分析解答;
(3)分析题目所给信息,明确各装置的作用,了解实验探究原理,从而得出结论.
点评:本题是一道综合性较强的实验题,既有实验探究,又有对方案的评价等知识,要根据题意结合所学知识细心分析才能正确解答.

练习册系列答案
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案
相关题目
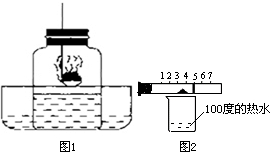


 (1)测定空气中氧气体积分数的实验装置如图所示.在集气瓶内加入少量的水,并五等分水面以上容积,做上记号.用弹簧夹夹紧乳胶管.点燃燃烧匙内足量的红磷,立即伸入瓶中并把塞子塞紧.
(1)测定空气中氧气体积分数的实验装置如图所示.在集气瓶内加入少量的水,并五等分水面以上容积,做上记号.用弹簧夹夹紧乳胶管.点燃燃烧匙内足量的红磷,立即伸入瓶中并把塞子塞紧. 空气、水是人类赖以生存的自然资源.
空气、水是人类赖以生存的自然资源.