题目内容
根据下图浓盐酸的商标,回答下列问题。
| 盐酸化学纯(500 mL) 品名:盐酸 化学式:HCl相对分子质量36.5 密度:1.18 g·cm-3质量分数:37% |
(1)某研究小组的同学欲用该盐酸配制100 g 10%的稀盐酸,需该盐酸______g(保留一位小数),配制时应选用________(填“10 mL”或“50 mL”)量筒量取。
(2)小组同学用所配稀盐酸来测量水垢[主要成分为CaCO3和Mg(OH)2]中CaCO3的质量分数:
取10.0 g水垢,加入所配100 g 10%的稀盐酸中,测得各时间段内生成气体的质量如下表:
| 时间/min | 1 | 2 | 3 | 4 | 5 |
| 气体质量/g | 1.5 | 2.5 | 3.0 | 3.3 | 3.3 |
通过实验:计算该水垢中CaCO3的质量分数。
【解析】(1)溶液稀释前后溶质质量不变,设需要该盐酸的质量为x,则有100 g×10%=x·37%,x≈27.0 g,其体积为27.0 g÷1.18 g·cm-3≈22.9 mL,所以需要50 mL的量筒;(2)由表中数据可知,10.0 g水垢完全反应产生的二氧化碳气体质量为3.3 g,利用化学方程式便可求出CaCO3的质量,从而进一步求出水垢中CaCO3的质量分数。
设10.0 g水垢中CaCO3的质量为x
CaCO3+2HCl====CaCl2+H2O+CO2↑
100 44
x 3.3 g
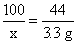 x=7.5 g
x=7.5 g
所以水垢中CaCO3的质量分数为: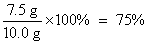
答案:(1)27.0 50 mL (2)75%

根据下图浓盐酸的商标,回答下列问题。

(1)某研究小组的同学欲用该盐酸配制100 g 10%的稀盐酸,需该盐酸 g(保留一位小数),配制时应选用 (填“10 mL”或“50 mL”)量筒量取。
(2)小组同学用所配稀盐酸来测量水垢[主要成分为CaCO3和Mg(OH)2]中CaCO3的质量分数:
取10.0 g水垢,加入所配100 g 10%的稀盐酸中,测得各时间段内生成气体的质量如下表:
| 时间/min | 1 | 2 | 3 | 4 | 5 |
| 气体质量/g | 1.5 | 2.5 | 3.0 | 3.3 | 3.3 |
通过实验:计算该水垢中CaCO3的质量分数。