题目内容
根据下图浓盐酸的商标,回答下列问题。

(1)某研究小组的同学欲用该盐酸配制100 g 10%的稀盐酸,需该盐酸 g(保留一位小数),配制时应选用 (填“10 mL”或“50 mL”)量筒量取。
(2)小组同学用所配稀盐酸来测量水垢[主要成分为CaCO3和Mg(OH)2]中CaCO3的质量分数:
取10.0 g水垢,加入所配100 g 10%的稀盐酸中,测得各时间段内生成气体的质量如下表:
| 时间/min | 1 | 2 | 3 | 4 | 5 |
| 气体质量/g | 1.5 | 2.5 | 3.0 | 3.3 | 3.3 |
通过实验:计算该水垢中CaCO3的质量分数。
【解析】(1)溶液稀释前后溶质质量不变,设需要该盐酸的质量为x,则有
100 g×10%=x·37%,x≈27.0 g,其体积为27.0 g÷1.18 g·cm-3≈22.9 mL,所以需要50 mL的量筒;(2)由表中数据可知,10.0 g水垢完全反应产生的二氧化碳气体质量为3.3 g,利用化学方程式便可求出CaCO3的质量,从而进一步求出水垢中CaCO3的质量分数。
设10.0 g水垢中CaCO3的质量为x
CaCO3+2HCl====CaCl2+H2O+CO2↑
100 44
x 3.3 g
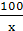 =
= x=7.5 g
x=7.5 g
所以水垢中CaCO3的质量分数为
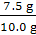 ×100% = 75%
×100% = 75%
答案:(1)27.0 50 mL (2)75%

 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案根据下图浓盐酸的商标,回答下列问题。
| 盐酸化学纯(500 mL) 品名:盐酸 化学式:HCl相对分子质量36.5 密度:1.18 g·cm-3质量分数:37% |
(1)某研究小组的同学欲用该盐酸配制100 g 10%的稀盐酸,需该盐酸______g(保留一位小数),配制时应选用________(填“10 mL”或“50 mL”)量筒量取。
(2)小组同学用所配稀盐酸来测量水垢[主要成分为CaCO3和Mg(OH)2]中CaCO3的质量分数:
取10.0 g水垢,加入所配100 g 10%的稀盐酸中,测得各时间段内生成气体的质量如下表:
| 时间/min | 1 | 2 | 3 | 4 | 5 |
| 气体质量/g | 1.5 | 2.5 | 3.0 | 3.3 | 3.3 |
通过实验:计算该水垢中CaCO3的质量分数。