题目内容
【题目】金属——工业的脊梁
金属及合金广泛应用于生活、生产和航天军工。
资料:水圈和岩石圈中含有丰富的镁元素。工业生产中,可用菱镁矿做原科制'备金属镁,流程如图所示:
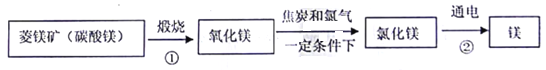
请回答下列问题:
(l)已知①和②属于分解反应,化学方程式分别为_________和___________。
(2)通过化学反应,以岩石圈的矿石为原料还可以制备很多其他金属,请举一例说明(用化学方程式表示其制备原理)______________。
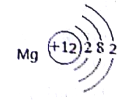
(3)下图是镁原子结构示意图,镁化学性质活泼,原因是________。四大圈层中含有下列物质:①硫酸铜;②氯化钠;③硫酸;④氢氧化钙;⑤氧气。其中能和铁反应的物质有(填序号)________。
(4)小梅同学将点燃的镁条伸入盛二氧化碳的集气瓶中,看到镁条剧烈燃烧,发出耀眼白光,瓶壁上有黑色物质生成,她认为这种黑色物质是碳单质。在上述过程中,小梅运用的科学方法有______________。
【答案】 MgCO3![]() MgO+ CO2↑ MgCl2
MgO+ CO2↑ MgCl2 ![]() Mg+Cl2↑ 一氧化碳还原氧化铁(或四氧化三铁),或电解氧化铝的方程式 镁原子最外层电子数为2,在化学反应中易失电子 ①③⑤ 实验、观察、推理
Mg+Cl2↑ 一氧化碳还原氧化铁(或四氧化三铁),或电解氧化铝的方程式 镁原子最外层电子数为2,在化学反应中易失电子 ①③⑤ 实验、观察、推理
【解析】(1)根据题意,碳酸镁在高温条件下,能发生分解反应生成氧化镁,化学反应前后元素的种类不变、原子个数不变,反应的化学方程式为:MgCO3![]() MgO+ CO2↑,氯化镁在通电条件下,发生分解反应生成镁和氯气,MgC12
MgO+ CO2↑,氯化镁在通电条件下,发生分解反应生成镁和氯气,MgC12 ![]() Mg+C12↑。(2)一氧化碳具有还原性,能把金属氧化物还原为金属单质,Fe2O3+3CO
Mg+C12↑。(2)一氧化碳具有还原性,能把金属氧化物还原为金属单质,Fe2O3+3CO ![]() 2Fe+3CO2 (3)镁原子最外层有2个电子,在化学反应中易失电子,所以镁化学性质活泼。①铁位于铜的前面,所以铁能与硫酸铜反应;②氯化钠不与铁反应;③硫酸能与铁反应生成硫酸亚铁和氢气;④氢氧化钙不能与铁反应;⑤氧气能与铁反应。故选①③⑤。(4)小梅同学将点燃的镁条伸入盛二氧化碳的集气瓶中,看到镁条剧烈燃烧,发出耀眼白光,运用的科学方法是实验,瓶壁上有黑色物质生成,运用的科学方法是观察,她认为这种黑色物质是碳单质,运用的科学方法是推理。
2Fe+3CO2 (3)镁原子最外层有2个电子,在化学反应中易失电子,所以镁化学性质活泼。①铁位于铜的前面,所以铁能与硫酸铜反应;②氯化钠不与铁反应;③硫酸能与铁反应生成硫酸亚铁和氢气;④氢氧化钙不能与铁反应;⑤氧气能与铁反应。故选①③⑤。(4)小梅同学将点燃的镁条伸入盛二氧化碳的集气瓶中,看到镁条剧烈燃烧,发出耀眼白光,运用的科学方法是实验,瓶壁上有黑色物质生成,运用的科学方法是观察,她认为这种黑色物质是碳单质,运用的科学方法是推理。

 名校课堂系列答案
名校课堂系列答案