题目内容
人类的生产和生活都离不开金属.
(1)金属元素在自然界中分布很广,地壳中含量最多的金属元素是 .金属以矿物形式存在,下列矿石的主要成分属于氧化物的是 (填化学式).
赤铁矿 孔雀石 铝土矿
(主要成分Fe2O3)〔主要成分Cu2(OH)2CO3〕(主要成分Al2O3)
(2)金属的回收和利用是保护金属资源的一种有效途径.
①废钢铁可回收重新冶炼,用一氧化碳还原氧化铁的化学方程式为 .
②向含有AgNO3、Cu(NO3)2、Zn(NO3)2的混合溶液中加入一定量的铁粉,使其充分反应后,过滤,向滤渣中滴加稀盐酸,有气泡产生,则下列结论正确的是
(3)某次实验结束时,同学们将含有CuSO4、ZnSO4、FeSO4的废液倒在废液缸里,如果将废液直接排放会造成水污染.于是几位同学利用课余时间处理废液,回收工业重要原料硫酸锌和有关金属.实验过程如下:
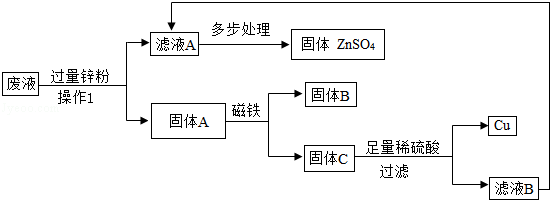
请回答:
①操作1的名称是 ;固体A的成分为 .
②若要检验向固体C中加入的稀硫酸是否足量的方法是 .
③若实验过程中的物质损失可以忽略,要计算该废液中硫酸锌的质量分数,必须称量废液的质量、蒸发得到固体硫酸锌的质量和 ..
(1)金属元素在自然界中分布很广,地壳中含量最多的金属元素是 .金属以矿物形式存在,下列矿石的主要成分属于氧化物的是 (填化学式).
赤铁矿 孔雀石 铝土矿
(主要成分Fe2O3)〔主要成分Cu2(OH)2CO3〕(主要成分Al2O3)
(2)金属的回收和利用是保护金属资源的一种有效途径.
①废钢铁可回收重新冶炼,用一氧化碳还原氧化铁的化学方程式为 .
②向含有AgNO3、Cu(NO3)2、Zn(NO3)2的混合溶液中加入一定量的铁粉,使其充分反应后,过滤,向滤渣中滴加稀盐酸,有气泡产生,则下列结论正确的是
| A.固体中一定有Fe、Ag,可能有 Cu、Zn |
| B.固体中一定有Fe、Zn,可能有 Cu、Ag |
| C.滤液中一定含Fe2+、Zn2+,不含Cu2+、Ag+ |
| D.滤液中一定含Zn2+、Fe2+,可能含Cu2+ |

请回答:
①操作1的名称是 ;固体A的成分为 .
②若要检验向固体C中加入的稀硫酸是否足量的方法是 .
③若实验过程中的物质损失可以忽略,要计算该废液中硫酸锌的质量分数,必须称量废液的质量、蒸发得到固体硫酸锌的质量和 ..
(1)Al;Fe2O3、Al2O3;(2)Fe2O3+3CO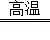 2Fe+3CO2;C;(3)①过滤;Zn、Fe、Cu;
2Fe+3CO2;C;(3)①过滤;Zn、Fe、Cu;
②取少量铜,加适量稀硫酸,若无气泡产生,证明硫酸足量;③操作1中加入锌粉的质量.
 2Fe+3CO2;C;(3)①过滤;Zn、Fe、Cu;
2Fe+3CO2;C;(3)①过滤;Zn、Fe、Cu;②取少量铜,加适量稀硫酸,若无气泡产生,证明硫酸足量;③操作1中加入锌粉的质量.
试题分析:(1)地壳中含量最多的金属元素是铝元素,氧化物是指含有两种元素其中一种是氧元素的纯净物,所以下列矿石的主要成分属于氧化物的是Fe2O3和Al2O3;(2)①一氧化碳还原氧化铁生成铁和二氧化碳,化学方程式为Fe2O3+3CO
 2Fe+3CO2;②向含有
2Fe+3CO2;②向含有AgNO3、Cu(NO3)2、Zn(NO3)2的混合溶液中加入一定量的铁粉,铁粉先和硝酸银溶液反应生成银和硝酸亚铁,反应完后再和硝酸铜溶液反应生成铜和硝酸亚铁,铁粉不和硝酸锌溶液反应,所以使其充分反应后,过滤,向滤渣中滴加稀盐酸,有气泡产生,说明一定金属铁有剩余,故滤液中一定含Fe2+、Zn2+,不含Cu2+、Ag+;(3)锌先和硫酸铜溶液反应生成铜和硫酸锌,反应完后再和硫酸亚铁溶液反应生成铁和硫酸锌.①过滤用于分离不溶性固体,所以操作1的名称是过滤;加入过量的锌粉,所以固体A的成分为 Zn、Fe、Cu;②若要检验向固体C中加入的稀硫酸是否足量的方法是取少量铜,加适量稀硫酸,若无气泡产生,证明硫酸足量;③若实验过程中的物质损失可以忽略,要计算该废液中硫酸锌的质量分数,必须称量废液的质量、蒸发得到固体硫酸锌的质量和操作1中加入锌粉的质量.

练习册系列答案
相关题目

