亚硫酸钠在印染、造纸等众多行业中有着广泛的应用。某研究小组采用如下实验流程用Na2CO3溶液吸收SO2制备Na2SO3。
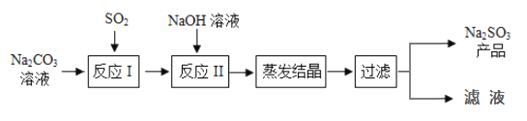
反应Ⅰ中随着SO2的增加,依次发生如下化学反应:
SO2+H2O+2Na2CO3=Na2SO3+2NaHCO3;
SO2+2NaHCO3=Na2SO3+2CO2↑+H2O;
SO2+H2O+Na2SO3=2NaHSO3
(1)H2SO3的名称为亚硫酸,则Na2SO3的名称为______。
(2)分析反应1提供的资料,向碳酸钠溶液通入二氧化硫的过程中,溶液中有关组分的质量分数变化如图1所示。则线1表示______(填化学式,下同)的质量分数的变化情况,线2表示______的质量分数的变化情况。
(3)实验时,“反应Ⅱ”中加入NaOH溶液的目的是将反应I中生成的NaHSO3转化为Na2SO3则该化学反应方程式为______。
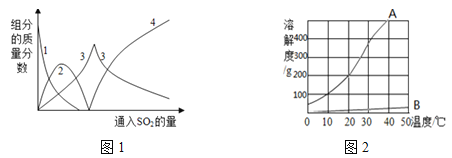
(4)常用蒸发结晶的方法分离混合溶液得到Na2SO3,由此可知,Na2SO3的溶解度曲线是与图2中的______(填A或B)物质的溶解度曲线相似。
(5)过滤操作得到的滤液中一定含有的溶质的化学式为______。
(6)实验后,将Na2SO3样品放置在烧杯中,一段时间后,检测发现样品中出现Na2SO4杂质,且放置时间越长产生的Na2SO4越多,则Na2SO3样品变质为Na2SO4的化学反应方程式为______。