题目内容
【题目】(7分)利用废旧电池铜帽(含Cu、Zn)制取海绵铜(Cu),并得到硫酸锌溶液,主要流程如下(反应条件已略去):
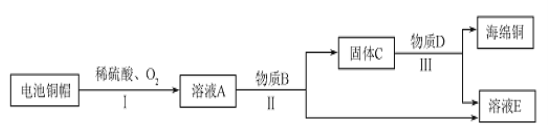
已知:2Cu+2H2SO4+O2![]() 2CuSO4+2H2O 、Zn+CuSO4= ZnSO4+Cu
2CuSO4+2H2O 、Zn+CuSO4= ZnSO4+Cu
(1)过程中I中稀硫酸过量的目的是 。
(2)过程Ⅱ中分离操作的名称是 ,在操作过程中使用到的玻璃仪器有烧杯、玻璃棒和 ,其中玻璃棒的作用是 。
(3)过程Ⅲ中有气体产生,该气体是 (填化学式)。
(4)A~E 中含铜、锌两种元素的物质有 (填字母序号)。
(5)为了得到纯净的海绵铜,过程Ⅲ中过滤后应 、干燥。
【答案】(1)将Cu、Zn完全反应 (2)过滤 普通漏斗 引流 (3)H2 (4)A、C (5)洗涤
【解析】
试题分析:电池铜帽中有铜和锌,加入过量的稀硫酸之后,铜和锌都被完全反应,所以过量的稀硫酸的目的是将铜和锌完全反应,反应之后,得到的溶液A中有硫酸铜和硫酸锌,还有过量的稀硫酸,加入B物质之后得到了固体和液体,将固体和液体分离开来的方法是过滤,过滤中使用的玻璃仪器有烧杯,玻璃杯和漏斗,B能够将铜反应出来,为了不引入新的杂质,若B应该是锌,锌比铜活泼,能将铜置换出来,而所加入锌的量也应该是过量的,所以固体C中出来有铜,还有过量的锌,除去过量的锌,应该加稀硫酸,所以此过程中会有氢气产生,由以上分析溶液E是硫酸锌,A-E中,含铜,锌两种元素的是A,C,为了得到纯净的海绵铜,过程Ⅲ中过滤后应对固体进行洗涤和干燥。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目