题目内容
【题目】(8分)如下图所示,现有甲、乙、丙、X、Y、Z六种物质,其中连线两端的甲、乙、丙溶液两两之间能发生反应;X、Y、Z之间只通过一步反应就能实现如箭头所指方向的转化。
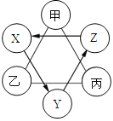
(1)若Y为黑色固体氧化物,Z为蓝色溶液,则Y的化学式为 ,Z生成X的反应基本类型是 ;
(2)若甲为胃酸的主要成分,乙可改良酸性土壤;则乙与丙反应的化学方程式可能为 ;
(3)若X、Y、Z三种物质都是建筑材料,其中X可做干燥剂,则Y生成Z的化学方程式为 。
【答案】(1)CuO 置换反应 (2)Ca(OH)2 + Na2CO3 =CaCO3↓+2NaOH;
(3)Ca(OH)2+CO2 =CaCO3↓ + H2O
【解析】
试题分析:(1)框图式的推断题,抓住一些特殊的反应现象、特殊的性质及特殊的反应条件等级题目的“题眼”, 该题的题眼是Y为黑色固体氧化物,Z为蓝色溶液,,可推断Y为氧化铜,Z为为可溶性铜盐,X应为单质铜,故Y的化学式为CuO;Z生成X的反应即金属与可溶性铜盐发生生成铜,故基本类型是置换反应
(2)若甲为胃酸的主要成分,为盐酸,乙可改良酸性土壤,为熟石灰,既能与盐酸反应,又能与熟石灰反应,故可推断丙为可溶性的碳酸盐(常见的为碳酸钠溶液),故乙与丙反应的化学方程式可能为: Ca(OH)2 + Na2CO3 =CaCO3↓+2NaOH;
(3)若X、Y、Z三种物质都是建筑材料,其中X可做干燥剂,则可判断X为氧化钙,Y为氢氧化钙,Z为碳酸钙,故Y生成Z的化学方程式为:Ca(OH)2+CO2 =CaCO3↓+ H2O

练习册系列答案
相关题目