题目内容
【题目】工业上用电解饱和NaCl溶液的方法制烧碱,其反应的化学方程式如下:2NaCl+2H2O ![]() 2NaOH+H2↑+Cl2↑
2NaOH+H2↑+Cl2↑
(1)已知20℃时,NaCl的溶解度为36g,其饱和溶液中溶质和溶剂的质量比为 .
(2)20℃时,取136g饱和NaCl溶液电解,当NaCl转化了32.5%时,理论上剩余溶液的质量为多少?
【答案】
(1)9:25
(2)解:设生成H2的质量为x,生成Cl2的质量为y
2NaCl+2H2O | H2↑+ | Cl2↑ |
117 | 2 | 71 |
36g×32.5% | x | y |
![]()
x=0.2g
y=7.1g
剩余溶液的质量=136g0.2g7.1g=128.7g,
答:剩余溶液的质量为128.7g
【解析】解:(1)20℃时,NaCl的溶解度为36g,所以饱和溶液中溶质和溶剂的质量比为:36g:100g=9:25; 所以答案是:(1)9:25;(2)剩余溶液的质量为128.7g.
【考点精析】通过灵活运用固体溶解度的概念和根据化学反应方程式的计算,掌握溶解度定义:在一定温度下,某固态物质在100g溶剂里达到饱和状态时所溶解的质量;四要素:①条件:一定温度②标准:100g溶剂③状态:达到饱和④质量:单位:克;各物质间质量比=系数×相对分子质量之比即可以解答此题.

【题目】CO2通入NaOH溶液中没有明显现象,CO2与NaOH是否发生了化学反应呢?某化学兴趣小组的同学们对此进行了探究. 【查阅资料】①通常情况下,1体积水溶解1体积的CO2 .
②在一定浓度的溶液中,有微溶物生成的复分解反应也能发生.
(1)【实验探究】小红同学设计了如图所示的实验装置(锥形瓶内充满CO2),并进行实验. 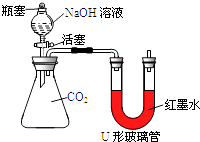
打开瓶塞和活塞,使NaOH溶液快速滴入锥形瓶中,立即关闭活塞(漏斗中仍有溶液剩余),观察到U形管左侧的红墨水液面(填“升高”、“降低”或“不移动”),小红根据现象判断CO2和NaOH发生了反应,理由是 . 请根据初中化学知识写出CO2与NaOH溶液反应的化学方程式: .
(2)【反思与评价1】小明认为小红的实验方案不严密,理由是 .
(3)【拓展实验】兴趣小组的同学们为此又设计了下表所示的两种方法,进一步探究.请填写表中的空格.
实验方法 | 操作过程 | 现象 | 实验结论 |
方法一 | 取小红实验后锥形瓶内的溶液适量,加入足量CaCl2溶液 | 有白色沉淀生成 | CO2与NaOH发生了反应 |
方法二 | 取小红实验后锥形瓶内的溶液适量,加入足量稀硫酸 |
(4)【反思与评价2】同学们经过讨论,认为【拓展实验】的(填“方法一”或“方法二”)依然不严密,理由是(用化学方程式表示).