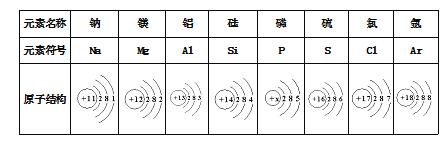
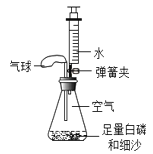
题目内容
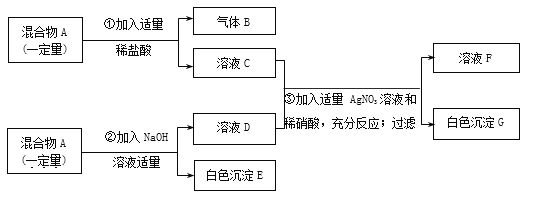
【题目】下列物质间有如下转化关系。已知固体G为常见的化合物,常用做建筑材料,溶液E、H、M中均只含有两种元素,请回答:
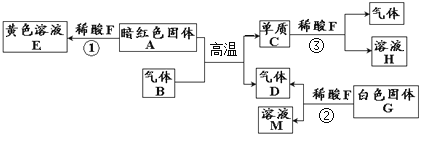
(1)写出指定物质的化学式:D________ H________
(2)写出反应①的化学基本反应类型_____________________
(3)写出反应②的化学方程式_____________________
(4)写出反应③的化学方程式______________________
【答案】CO2 FeCl2 复分解反应 CaCO3+2HCl=CaCl2+H2O+CO2↑ Fe+2HCl=FeCl2+H2↑
【解析】
根据所学知识和题中信息知,A是暗红色固体与稀酸反应,E是黄色液体且只含有两种元素是氯化铁,A是氧化铁,F是稀盐酸,A+B![]() C+D,B是一氧化碳,C是铁,D是二氧化碳,C+F→H,H是氯化亚铁,固体G为常见的化合物,常用做建筑材料,G+F→D+M,G是碳酸钙,D是氯化钙。(1)化学式:D是CO2,H是FeCl2。 (2)反应①的化学基本反应类型,Fe2O3 + 6HCl =2FeCl3 +3H2O,两种化合物反应,相互交换成分生成另两种化合物,属于复分解反应。(3)反应②的化学方程式是CaCO3 + 2HCl =CaCl2 + H2O + CO2↑。(4)反应③的化学方程式是Fe + 2HCl = FeCl2 + H2↑,盐酸或硫酸与铁反应生成亚铁盐。
C+D,B是一氧化碳,C是铁,D是二氧化碳,C+F→H,H是氯化亚铁,固体G为常见的化合物,常用做建筑材料,G+F→D+M,G是碳酸钙,D是氯化钙。(1)化学式:D是CO2,H是FeCl2。 (2)反应①的化学基本反应类型,Fe2O3 + 6HCl =2FeCl3 +3H2O,两种化合物反应,相互交换成分生成另两种化合物,属于复分解反应。(3)反应②的化学方程式是CaCO3 + 2HCl =CaCl2 + H2O + CO2↑。(4)反应③的化学方程式是Fe + 2HCl = FeCl2 + H2↑,盐酸或硫酸与铁反应生成亚铁盐。
点睛∶这是一道推断题,掌握常见物质的性质和用途是顺利完成本题的重要前提。盐酸或硫酸与铁反应生成亚铁盐。氯化铁溶液呈黄色。

【题目】水是一种重要的资源。
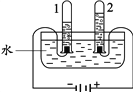
(1)电解水实验揭示了水的组成。下图实验中得到氧气的试管是________(填“1”或“2”)。
(2)水分解的微观示意图如下,方框内应是_________(填字母序号)。
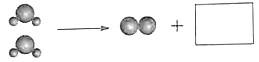
|
|
|
|
A | B | C | D |
(3)海水淡化可缓解淡水资源匮乏的问题。下图为太阳能海水淡化装置示意图。
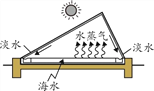
① 水变成水蒸气的过程中,不发生变化的是_______(填字母序号)。
A.分子质量 B.分子种类 C.分子间隔
② 利用该装置将一定量的海水暴晒一段时间后,剩余海水中氯化钠的质量分数会________(填“变大”“变小”或“不变”)。
【题目】某化学活动小组合作学习氢氧化钠和氢氧化钙的相关知识。
[活动1]下表是Ca(OH)2和NaOH的溶解度数据。请回答下列问题:
温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 | |
溶解度/g | Ca(OH)2 | 0.19 | 0.17 | 0.14 | 0.12 | 0.09 | 0.08 |
NaOH | 31 | 91 | 111 | 129 | 313 | 336 | |

(1)依据上表数据,绘制了Ca(OH)2和NaOH的溶解度曲线,右图中能表示NaOH溶解度曲线的是_________(填“A”或“B”);
(2)将一瓶接近饱和的Ca(OH)2溶液变成饱和溶液,具体措施有:①加入氢氧化钙A B②升高温度 ③降低温度 ④加入水 ⑤蒸发水后再恢复到原温度 ⑥加入生石灰。其中措施正确的是_______(填字母);
A、②④⑥ B、③④ C、①③⑤⑥ D、①②⑤⑥
(3)20℃时,191g饱和NaOH溶液,蒸发10g水后,再恢复到20℃,可析出NaOH固体。这时溶液的质量分数为____________;
(4)现有20℃时Ca(OH)2的饱和溶液甲,向其中加入一定量CaO后得到溶液乙,此时溶液中溶质的质量乙_______(填“>”或“<”“=”)甲;
[活动2]20℃时,欲测定NaOH溶液的pH,若先将pH试纸用蒸馏水润湿,再进行测定,则所测溶液的pH_________________(填“偏大”或“偏小”“不受影响”)。
[活动3]用化学方法鉴别氢氧化钠溶液和澄清石灰水实验方案为___________。