题目内容
【题目】某校化学小组在利用盐酸和氢氧化钠溶液探究酸碱中和反应时,利用数字化传感器测得烧杯中溶液pH的变化图象如下面图一所示,溶液的温度变化如图二所示(不考虑反应过程中热量损失)。请回答下列问题:
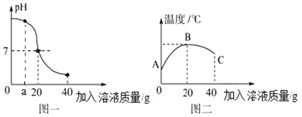
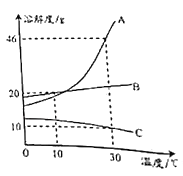
⑴图一:该变化对应的实验操作是将______滴加到另一种溶液中。当滴入溶液的质量为ag时,溶液中的溶质为_________(填化学式)。当溶液的pH=7时,溶液中的主要离子是______________(填离子符号)。当加入溶液的质量为40g时,向所得溶液中滴加紫色石蕊试液,溶液呈_______色。
⑵图二:表示酸碱恰好完全反应的点是____,说明该反应伴随_____现象(填“放热”或“吸热”)。
⑶如果实验中用去了20g溶质质量分数为4%的氢氧化钠溶液,根据图示计算稀盐酸中溶质的质量分数为_________________。
【答案】 盐酸 NaCl和NaOH Na+ 、Cl- 红 B 放热 3.65 %
【解析】本题主要考查中和反应的现象,溶液的酸碱性和pH之间的关系,根据化学方程式计算。
(1)根据图像可以看出,开始溶液呈碱性,后来呈酸性,是将盐酸加入到氢氧化钠溶液中;当滴入溶液的质量为ag时,氢氧化钠过量,溶液中的溶质为NaCl和NaOH;当溶液的pH=7时,氢氧化钠和盐酸恰好完全反应,溶液中的溶质是氯化钠,溶液中的主要离子是Na+ 、Cl-;当加入溶液的质量为40g时,盐酸溶液过量,溶液呈酸性,向所得溶液中滴加紫色石蕊试液,溶液是红色;
(2)根据图像可知,反应过程中温度逐渐升高,说明该反应伴随放热现象,当酸碱恰好完全反应时放出的热量最多,溶液的温度最高,所以图二表示酸碱恰好完全反应的点是B。
(3)由图像可知,恰好酸碱中和时消耗稀盐酸的质量是20g。
设:20g的稀盐酸中溶质的质量为x,
HCl+NaOH═NaCl+H2O
36.5 40
x 20g×4%
![]() 解得x=0.73g
解得x=0.73g
稀盐酸中溶质的质量分数=![]() ×100%=3.65%。
×100%=3.65%。

 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案