题目内容
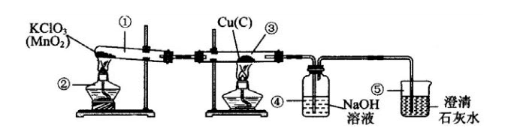
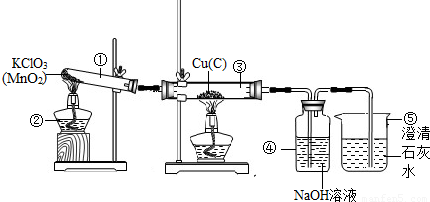
某科技小组的同学利用天然资源获得了红褐色的铜粉(含杂质炭),为了测定该铜粉样品中铜的质量分数(百分含量),取Wg铜粉样品,设计如下实验装置:

(1)仪器②、⑤的名称是:②________、⑤________.
(2)①、④中发生反应的化学方程式为:
①________,④________.
(3)装置③中的实验现象是________.
(4)结束实验时,先熄灭两个酒精灯,在冷却过程中可能导致的后果是________.
(5)利用上述装置,通过称量反应前后装置④的质量,得到CO2的质量,进而求出铜的质量分数(实验过程中忽略水蒸气的影响).为了确保测得的CO2质量准确可靠,在保证装置不漏气、称量准确、操作规范的前提下,你认为还需要的条件是________________.
解析:
|
答案:(1)酒精灯 烧杯 (2) 解析:本题属于综合探究实验题,可按“综合探究实验解题三步骤”的思路展开分析.首先要明确该实验的目的是“测定该铜粉样品中铜的质量分数”.然后围绕该实验目的,分析题给实验装置中可能涉及的反应原理及装置作用,装置①是利用KClO3受热催化分解制取氧气;装置③是利用氧气与铜粉样品中的Cu和C发生反应分别生成CuO黑色固体和CO2气体;生成的CO2气体进入装置④中与NaOH溶液反应而被吸收,可根据装置④的增重测得杂质炭生成的CO2的质量,再换算为杂质炭的质量,用铜粉样品质量减去炭的质量就是铜的质量,由此求得铜的质量分数;装置⑤中的澄清石灰水可检验是否还有未被NaOH溶液吸收的CO2通过.最后紧扣题意回答有关的问题,对于问题(1)~(3)根据上述原理分析不难回答;对于问题(4)要借鉴平时小结的“加热固体制取氧气、并用排水法收集氧气要防止液体倒流导致试管破裂”的实验经验来回答;对于问题(5)要根据题意“通过称量反应前后装置④的质量,得到CO2的质量,进而求出铜的质量分数”的原理和“确保测得的CO2质量准确可靠”的实验要求,“在保证装置不漏气、称量准确、操作规范的前提下”,分析“还需要的条件”:一是氯酸钾必须足量(或过量),以提供足量的氧气把杂质炭氧化成CO2;二是NaOH溶液也必须足量,以保证把生成的CO2全部吸收. |