题目内容
平果工业园是以铝加工为主的大型科技工业园区.某工厂以铝锭、铜、铁等熔炼制成合金用于生产汽车轮毂及高档门板材.基本生产流程如图所示:
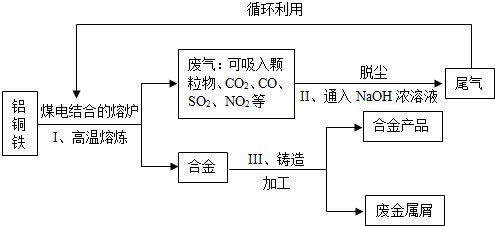
试回答下列问题:
(1)废气中含有SO2气体的原因是 ,尾气循环利用的优点是 .
(2)步骤Ⅱ中NaOH浓溶液可吸收的气体是 ,写出其中的一个反应的化学方程式 .
(3)某活动小组欲从废金属屑中提取较为贵重的金属铜,经过查阅资料和咨询老师后设计如下方案,请你参与他们的研究实践活动.
查阅资料:
①废金属屑中除了含铝、铜、铁之外,还有氧化铜、氧化铁和氧化铝等.(假设不含难溶于酸的其他杂质)
②金属铁及其氧化物、氧化铜能与稀硫酸反应,但不能跟碱溶液反应.铝和氧化铝分别为两性金属和氧化物,既能跟稀硫酸反应,又能与强碱氢氧化钠溶液反应,如:
2Al+2NaOH+2H2O=2NaAlO2+3H2↑; Al2O3+2NaOH=2NaAlO2+H2O; NaAlO2溶液为无色.
③在溶液中Fe能将+3价铁离子转化为+2价的亚铁离子:Fe+Fe2(SO4)3 3FeSO4
设计方案:
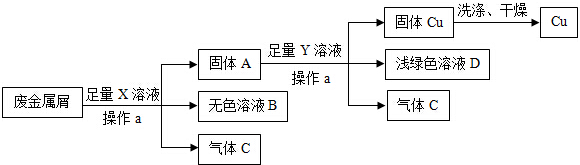
回答下列问题
①操作a是 ; X是 ;气体C名称是 .
②废金属屑中含有氧化铜,但反应后得到的溶液D并没有呈蓝色,原因是: (用化学方程式表示).

试回答下列问题:
(1)废气中含有SO2气体的原因是
(2)步骤Ⅱ中NaOH浓溶液可吸收的气体是
(3)某活动小组欲从废金属屑中提取较为贵重的金属铜,经过查阅资料和咨询老师后设计如下方案,请你参与他们的研究实践活动.
查阅资料:
①废金属屑中除了含铝、铜、铁之外,还有氧化铜、氧化铁和氧化铝等.(假设不含难溶于酸的其他杂质)
②金属铁及其氧化物、氧化铜能与稀硫酸反应,但不能跟碱溶液反应.铝和氧化铝分别为两性金属和氧化物,既能跟稀硫酸反应,又能与强碱氢氧化钠溶液反应,如:
2Al+2NaOH+2H2O=2NaAlO2+3H2↑; Al2O3+2NaOH=2NaAlO2+H2O; NaAlO2溶液为无色.
③在溶液中Fe能将+3价铁离子转化为+2价的亚铁离子:Fe+Fe2(SO4)3 3FeSO4
设计方案:

回答下列问题
①操作a是
②废金属屑中含有氧化铜,但反应后得到的溶液D并没有呈蓝色,原因是:
考点:物质的相互转化和制备,过滤的原理、方法及其应用,气体的净化(除杂),金属的化学性质,书写化学方程式、文字表达式、电离方程式,常用燃料的使用与其对环境的影响
专题:物质的制备
分析:(1)根据含硫物质燃烧的产物中有二氧化硫进行分析,根据一氧化碳具有可燃性进行分析;
(2)根据氢氧化钠浓溶液是碱性溶液,可以吸收酸性气体进行分析,根据题中所给的反应物、生成物依据质量守恒定律书写化学方程式;
(3)根据过滤操作可以将固体和液体分离进行分析,根据题中的反应流程和所给资料进行分析,根据铁会与硫酸铜发生置换反应进行分析.
(2)根据氢氧化钠浓溶液是碱性溶液,可以吸收酸性气体进行分析,根据题中所给的反应物、生成物依据质量守恒定律书写化学方程式;
(3)根据过滤操作可以将固体和液体分离进行分析,根据题中的反应流程和所给资料进行分析,根据铁会与硫酸铜发生置换反应进行分析.
解答:解:(1)煤中含有一定量的硫,硫燃烧会生成二氧化硫,所以废气中含有SO2气体的原因是:煤中含有硫元素,硫燃烧生成SO2,废气通过氢氧化钠溶液吸收,会将二氧化硫、二氧化碳、二氧化氮除去,一氧化碳有毒,燃烧可以提供大量的热,所以尾气循环利用的优点是:充分利用尾气中的可燃性气体CO,防止污染;
(2)氢氧化钠溶液显碱性,能够吸收酸性气体,所以步骤Ⅱ中NaOH浓溶液可吸收的气体是:CO2 SO2 NO2,氢氧化钠和二氧化碳反应生成碳酸钠和水,化学方程式为:CO2+2NaOH=Na2CO3+H2O;
(3)①通过操作a分离后,得到了固体和液体,所以操作a是:过滤,通过分析可知,废金属屑中除了含铝、铜、铁之外,还有氧化铜、氧化铁和氧化铝,从转化流程可以看出,加入的X可以和铝、氧化铝反应,所以X是氢氧化钠溶液,铝和氢氧化钠反应会生成偏铝酸钠和氢气,所以气体C名称是氢气;
②通过分析可知,铁会与硫酸铜反应生成硫酸亚铁和铜,所以废金属屑中含有氧化铜,但反应后得到的溶液D并没有呈蓝色,原因是:CuSO4+Fe=Cu+FeSO4.
故答案为:(1)煤中含有硫元素,硫燃烧生成SO2;充分利用尾气中的可燃性气体CO,防止污染;
(2)CO2 SO2 NO2,CO2+2NaOH=Na2CO3+H2O;
(3)①过滤,氢氧化钠溶液,氢气;
②CuSO4+Fe=Cu+FeSO4.
(2)氢氧化钠溶液显碱性,能够吸收酸性气体,所以步骤Ⅱ中NaOH浓溶液可吸收的气体是:CO2 SO2 NO2,氢氧化钠和二氧化碳反应生成碳酸钠和水,化学方程式为:CO2+2NaOH=Na2CO3+H2O;
(3)①通过操作a分离后,得到了固体和液体,所以操作a是:过滤,通过分析可知,废金属屑中除了含铝、铜、铁之外,还有氧化铜、氧化铁和氧化铝,从转化流程可以看出,加入的X可以和铝、氧化铝反应,所以X是氢氧化钠溶液,铝和氢氧化钠反应会生成偏铝酸钠和氢气,所以气体C名称是氢气;
②通过分析可知,铁会与硫酸铜反应生成硫酸亚铁和铜,所以废金属屑中含有氧化铜,但反应后得到的溶液D并没有呈蓝色,原因是:CuSO4+Fe=Cu+FeSO4.
故答案为:(1)煤中含有硫元素,硫燃烧生成SO2;充分利用尾气中的可燃性气体CO,防止污染;
(2)CO2 SO2 NO2,CO2+2NaOH=Na2CO3+H2O;
(3)①过滤,氢氧化钠溶液,氢气;
②CuSO4+Fe=Cu+FeSO4.
点评:在解此类题时,首先分析题中的反应流程,然后结合学过的知识和题中所给的知识进行分析解答.

练习册系列答案
相关题目
我们每时每刻都离不开空气,空气充分的微小变化都会直接影响人类的生存,你关注每天的空气质量报告吗?下列气体应计入空气污染指数的有害气体是( )
| A、氮气 | B、二氧化碳 |
| C、二氧化氮 | D、氧气 |
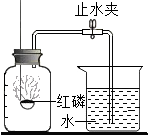 某同学设计了测定空气中氧气含量的实验,实验装置如图.该同学的实验步骤如下:
某同学设计了测定空气中氧气含量的实验,实验装置如图.该同学的实验步骤如下:
 如图所示,这是一瓶用排水法收集好安放在桌面上的一瓶无色气体.据此请判断与这瓶气体相关的物理性质是:无色气体、
如图所示,这是一瓶用排水法收集好安放在桌面上的一瓶无色气体.据此请判断与这瓶气体相关的物理性质是:无色气体、