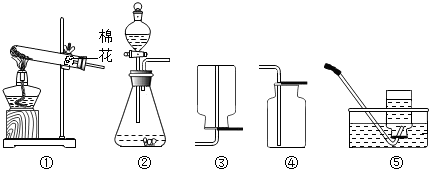
题目内容
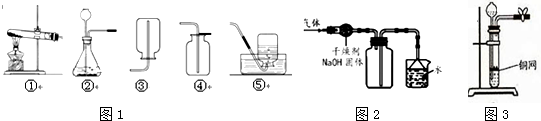
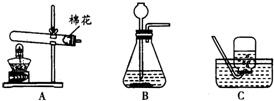
如图是实验室常用的制取气体和有关性质实验装置,根据所学知识回答下列问题: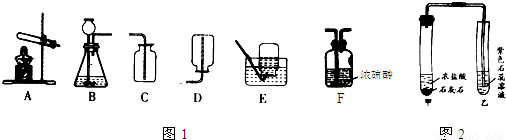
(1)用高锰酸钾制取氧气的化学方程式为 .
(2)利用最优的反应原理制取干燥的氧气,组装装置可以按顺序选用图中的(填标号) .
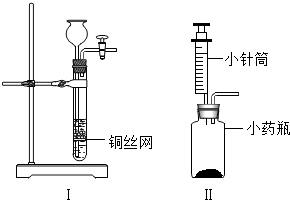
(3)小伟设计了如图2所示的装置进行实验(固定装置已略去,且石灰石中的杂质不反应):
①写出甲试管中发生反应的化学方程式 .
②小伟观察到乙试管中紫色石蕊试液变红,试分析所有可能使其变红的原因: .
【答案】分析:(1)用高锰酸钾制氧气时,反应物是高锰酸钾,生成物是锰酸钾、二氧化锰、氧气,反应条件是加热,写出反应的化学方程式;
(2)制取氧气最好的做法是过氧化氢溶液和二氧化锰混合,要得到干燥的氧气,需要吸水干燥并通过向上排空气法收集;
(3)①石灰石和盐酸可以制取二氧化碳,写出反应的方程式;
②根据浓盐酸的挥发性及二氧化碳的性质分析石蕊试液变红的原因.
解答:解:(1)用高锰酸钾制氧气时,反应物是高锰酸钾,生成物是锰酸钾、二氧化锰、氧气,反应条件是加热,因此反应的化学方程式为:2KMnO4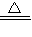 K2MnO4+MnO2+O2↑;
K2MnO4+MnO2+O2↑;
(2)制取氧气最好的做法是过氧化氢溶液和二氧化锰混合,因此选择的发生装置是B;再应该浓硫酸的吸水性进行干燥,用向上排空气法收集,故组装装置可以按顺序选用图中的BFC;
(3)①石灰石和盐酸可以制取二氧化碳,该反应的方程式为:CaCO3+2HCl=CaCl2+CO2↑+H2O;
②浓盐酸有挥发性,易挥发出氯化氢气体,氯化氢溶于水形成盐酸显酸性,能够使紫色的石蕊试液变成红色;二氧化碳和水反应形成碳酸也显酸性,能够使紫色的石蕊试液变成红色;
故答案为:(1)2KMnO4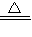 K2MnO4+MnO2+O2↑;
K2MnO4+MnO2+O2↑;
(2)BFC;
(3)①CaCO3+2HCl=CaCl2+CO2↑+H2O;②二氧化碳与水反应生成碳酸使紫色石蕊试液变红;浓盐酸挥发产生的氯化氢气体溶于水形成盐酸使紫色石蕊试液变红.
点评:本题考查了常见气体的制取装置、除杂、收集方法等的选择及气体的性质,并在此基础上进行拓展,关键是明确发生装置、收集方法选择的依据.
(2)制取氧气最好的做法是过氧化氢溶液和二氧化锰混合,要得到干燥的氧气,需要吸水干燥并通过向上排空气法收集;
(3)①石灰石和盐酸可以制取二氧化碳,写出反应的方程式;
②根据浓盐酸的挥发性及二氧化碳的性质分析石蕊试液变红的原因.
解答:解:(1)用高锰酸钾制氧气时,反应物是高锰酸钾,生成物是锰酸钾、二氧化锰、氧气,反应条件是加热,因此反应的化学方程式为:2KMnO4
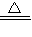 K2MnO4+MnO2+O2↑;
K2MnO4+MnO2+O2↑;(2)制取氧气最好的做法是过氧化氢溶液和二氧化锰混合,因此选择的发生装置是B;再应该浓硫酸的吸水性进行干燥,用向上排空气法收集,故组装装置可以按顺序选用图中的BFC;
(3)①石灰石和盐酸可以制取二氧化碳,该反应的方程式为:CaCO3+2HCl=CaCl2+CO2↑+H2O;
②浓盐酸有挥发性,易挥发出氯化氢气体,氯化氢溶于水形成盐酸显酸性,能够使紫色的石蕊试液变成红色;二氧化碳和水反应形成碳酸也显酸性,能够使紫色的石蕊试液变成红色;
故答案为:(1)2KMnO4
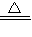 K2MnO4+MnO2+O2↑;
K2MnO4+MnO2+O2↑;(2)BFC;
(3)①CaCO3+2HCl=CaCl2+CO2↑+H2O;②二氧化碳与水反应生成碳酸使紫色石蕊试液变红;浓盐酸挥发产生的氯化氢气体溶于水形成盐酸使紫色石蕊试液变红.
点评:本题考查了常见气体的制取装置、除杂、收集方法等的选择及气体的性质,并在此基础上进行拓展,关键是明确发生装置、收集方法选择的依据.

练习册系列答案
 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案
相关题目
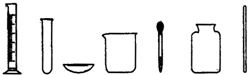
 如图是实验室常用的实验仪器与装置,根据所学知识回答下列问题:
如图是实验室常用的实验仪器与装置,根据所学知识回答下列问题: