题目内容
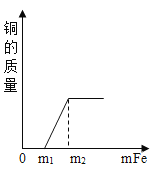
【题目】水与人们的生活有着密切的关系。为验证水的组成用如图所示装置进行实验。
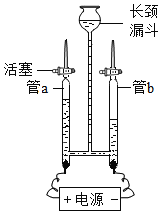
①写出该反应的化学方程式______。
②电解水的过程中,发生改变的微粒是______(写名称)。
③下列物质溶于水后能导电的是______(填字母)。
A 蔗糖 B 氯化氢 C 氯化钠 D 氢氧化钙
【答案】2H2O![]() 2H2↑+O2↑ 水分子 BCD
2H2↑+O2↑ 水分子 BCD
【解析】
解:
①电解水是水在通电的条件下生成氢气和和氧气,对应的化学方程式2H2O![]() 2H2↑+O2↑;
2H2↑+O2↑;
②分子构成的物质,分子是保持其物质化学性质的最小微粒。所以电解水的过程中,发生改变的微粒是 水分子;
③物质溶于水后能导电是因为能形成离子。
A.蔗糖溶于水,溶液中只有蔗糖分子和水分子,不存在可自由移动的离子,不能导电,故A错误;
B.氯化氢溶于水,离解氢离子和氯离子,能够导电,故B正确;
C.氯化钠溶于水,离解钠离子和氯离子,能够导电,故C正确;
D.氢氧化钙溶于水,离解钙离子和氢氧根离子,能够导电,故D正确。故选BCD。

【题目】甲、乙、丙、丁四种物质的相互反应关系如图所示,“—”表示相连的物质间能发生反应,下列符合对应反应关系的选项是

选项 | A | B | C | D | |
物 质 | 甲 | Ca(OH)2 | CO2 | H2 | Mg |
乙 | Na2CO3 | NaOH | O2 | HCl | |
丙 | H2SO4 | CaCl2 | CuO | CuSO4 | |
丁 | BaCl2 | K2CO3 | HCl | NaOH | |
A. AB. BC. CD. D
【题目】草酸镍晶体(NiC2O42H2O)可用于制镍催化剂。某小组用废镍催化剂(成分为Fe2O3、Ni、Fe、SiO2等)制备草酸镍晶体的部分实验流程如图所示:
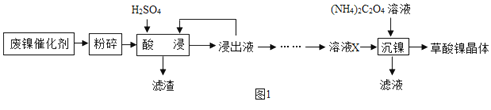
已知:①Ni能和稀H2SO4反应。
②相关金属离子生成氢氧化物沉淀的pH如下表
金属离子 | 开始沉淀的pH | 完全沉淀的pH |
Fe3+ | 1.1 | 3.2 |
Fe2+ | 5.8 | 8.8 |
Ni2+ | 6.7 | 9.5 |
③H2O2能将Fe2+氧化为Fe3+
(1)废镍催化剂“粉碎”的目的是______。
(2)保持其他条件相同,在不同温度下对废镍催化剂进行“酸浸”,镍浸出率随时间变化如图,“酸浸”的适宜温度与时间分别为______(填字母)。
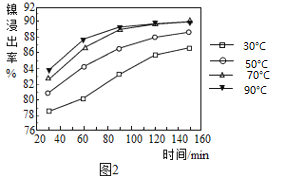
A 30℃、30min B 90℃、150min C 70℃、120min D 90℃、120min
(3)“酸浸”中发生的反应方程式为______(写1个即可)。
(4)“浸出液”得到“溶液x”过程中,加入试剂先后顺序是______(填字母)
A.先加H2O2溶液,再加NaOH溶液 B.先加NaOH溶液,再加H2O2溶液加NaOH溶液调节pH______(填范围),充分反应后得到滤渣的操作是______,该操作中所用到的玻璃仪器有玻璃棒、烧杯和______,其中玻璃棒的作用是______。
(5)将“沉镍”工序:①主要过程为:蒸发浓缩、______、过滤,所得固体用75%乙醇洗涤、110℃下烘干,得草酸镍晶体。
②用75%乙醇洗涤的目的是洗去杂质、______。
③烘干温度不超过110℃的原因是______。