题目内容
【题目】化学用语是学习化学的重要工具,请用化学用语填空:
(1)常用于改良酸性土壤的一种碱:______。
(2)2个铵根离子:______。
(3)“Fe2+”中数字“2”表示的意义是______。
(4)地壳中含量最多的非金属元素与含量最多的金属元素组成的化合物:______。
(5)写出一个生成白色沉淀的复分解反应:______。
【答案】Ca(OH)2 2NH4+ 一个亚铁离子带有两个单位的正电荷 Al2O3 ![]() (合理即可)
(合理即可)
【解析】
(1)氢氧化钙属于碱,可用于改良酸性土壤,其化学式为:![]() 。
。
(2)由离子的表示方法,在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略。若表示多个该离子,就在其元素符号前加上相应的数字,故2个铵根离子可表示为![]() 。
。
(3)标在元素符号右上角的数字表示1个离子所带的电荷数,Fe2+中的“2”表示一个亚铁离子带有两个单位的正电荷。
(4)地壳中含量最多的金属元素是铝元素,含量最多的非金属元素是氧元素,组成的化合物为氧化铝,氧化铝中铝元素显+3价,氧元素显-2价,其化学式为:Al2O3。
(5)碳酸钠与氢氧化钙溶液反应生成碳酸钙沉淀和氢氧化钠,是生成白色沉淀的复分解反应,反应的化学方程式为:![]() (合理即可)。
(合理即可)。
故答案为:
(1)![]() ;
;
(2)![]() ;
;
(3)一个亚铁离子带有两个单位的正电荷;
(4)Al2O3;
(5)![]() (合理即可)。
(合理即可)。

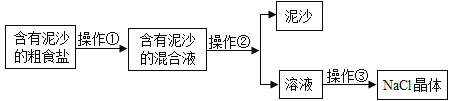
【题目】某校兴趣小组同学准备进行常见酸、碱、盐的性质探究实验时,发现实验台上摆放的药品中,有一瓶装溶液的试剂瓶未盖瓶盖且标签破损(如图所示),于是小组同学决定对这瓶溶液进行实验探究:
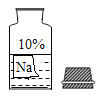
(提出问题)该试剂的成分是什么?
(交流讨论)根据受损标签的情况判断,这瓶试剂不可能是______(填字母)
A 酸 B 碱 C 盐
(查阅资料)
I.初中化学常见的含钠化合物有NaCl、NaOH,Na2CO3、NaHCO3
Ⅱ.Na2CO3、NaHCO3溶液都呈碱性。
Ⅲ.室温(20℃)时,上述四种物质的溶解度的数据如下:
物质 | NaCl | NaOH | Na2CO3 | NaHCO3 |
溶解度/g | 36 | 109 | 215 | 9.6 |
(得出结论)小华根据试剂瓶标注的溶质质量分数10%和上表中溶解度的数据判断这瓶试剂不可能是______
(做出猜想)①可能是NaOH溶液;②可能是Na2CO3溶液;③可能是NaCl溶液
(设计并进行实验)
(1)小强用洁净的玻璃棒蘸取该溶液滴在pH试纸上,测得pH>7,则猜想______错误。
(2)小强为了确定该溶液的成分,他又进行了如下实验:
操作步骤 | 实验现象 | 结论及化学方程式 |
取样于试管中,滴加足量的___________(填试剂的名称) | 产生大量的气泡 | 猜想 ②正确 |
老师指出该结论不严谨。理由是氢氧化钠溶液在空气中敞口放置会发生变质,变质后也能产生上述现象。请写出氢氧化钠在空气中变质的化学方程式:______。
(继续探究)另取样加入过量的CaCl2溶液,观察到有______产生,设计这一步骤的目的是_____,静置后,取上层清液,滴入无色酚酞溶液,溶液呈红色。
(实验结论)这瓶溶液原来是______。
(探究启示)做实验时取完药品后应______。
【题目】某学习小组对在实验中吸收过二氧化碳气体的碱石灰成分进行了研究。
(查阅资料)
(1)碱石灰是CaO与NaOH的固体混合物,通常用于吸收二氧化碳及干燥气体。
(2)碱性的Na2CO3溶液可以与中性的CaCl2溶液发生复分解反应。
(提出猜想)
该碱石灰的主要成分可能含有______、Ca(OH)2、CaCO3、NaOH和______。
(设计方案、收集证据)
(1)甲同学在烧杯中放入少量的碱石灰样品,加入足量蒸馏水,______(填操作名称)。使其充分溶解,静置有白色沉淀,甲同学认为原样品中一定含有CaCO3,乙同学认为他的结论不准确,原因是______(填化学方程式):
(2)乙同学进一步设计实验并进行验证,过程如下:
实验操作 | 实验现象 | 实验结论 |
①从甲同学的烧杯中取少量上层清液于试管中,向其中滴加足量 ______溶液。 | 有白色沉淀生成 | 生成白色沉淀的化学方程式_________ |
②过滤,向滤液中滴加无色酚酞试液 | 无明显现象 | 样品中不含 ______ |
(解释与评价)
(1)乙同学进一步设计了如图实验装置,通过称量B装置的稀盐酸质量变化来确定样品的成分及质量(气密性良好,每步均完全反应,操作无误)。多次实验发现测定结果有时偏大有时偏小偏差,试分析其主要原因:______。
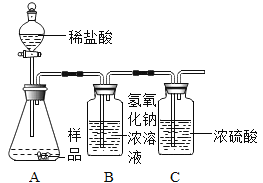
(2)在老师的指导下,乙同学完善了实验装置,并重新进行了实验,步骤如下:
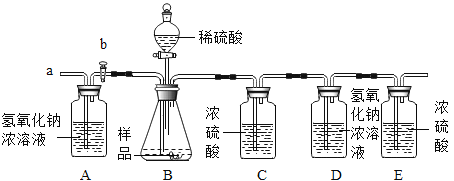
①检查装置的气密性,将5.06g干燥的样品放入锥形瓶中;
②向锥形瓶中逐滴加入稀硫酸至不再产生气泡;
③打开活塞b,从导管a处缓缓鼓入一定量的空气,关闭活塞b;
④称量盛有氢氧化钠浓溶液的D瓶质量;
⑤再次打开活塞b,从导管a处缓缓鼓入一定量的空气;
⑥再次称量D瓶质量,增重2.2g。
实验操作顺序为:______(用上述序号表示)。步骤⑤的作用是:______。通过分析及计算可知:5.06g样品中各成分及质量______。