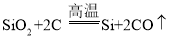题目内容
【题目】某同学从定量角度研究双氧水制取氧气的过程,对原实验进行部分改进,增加了称量操作.具体做法是:取10%的双氧水和少量的二氧化锰放入气体发生装置,并对反应前后混合物的质量进行称量,记录如下:
反应过程 | 反应前 | 反应后 |
质量变化(不含容器质量) | 34.3g | 32.7g |
若反应后,双氧水分解完全且氧气全部逸出,该同学得出的结论中,不合理的是
A.最多得到氧气的质量为1.6gB.反应速率逐渐加快
C.反应生成的水和氧气的质量比为9:8D.催化剂二氧化锰的质量为0.3g
【答案】B
【解析】
过氧化氢在二氧化锰催化作用下生成水和氧气。
A、根据质量守恒定律,反应前反应物的总质量等于生成物的总质量,减少的为生成的氧气的质量,则最多得到氧气的质量为![]() ,故A正确;
,故A正确;
B、随着反应的进行,过氧化氢的浓度减小,反应速率逐渐变小,故B不正确;
C、设生成的水的质量为x
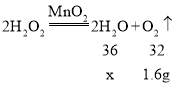
![]()
![]()
反应生成的水和氧气的质量比为![]() ,故C正确;
,故C正确;
D、设分解的过氧化氢的质量为y
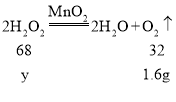
![]()
![]()
10%的双氧水溶液的质量为![]()
催化剂二氧化锰的质量为![]() ,故D正确。故选B。
,故D正确。故选B。

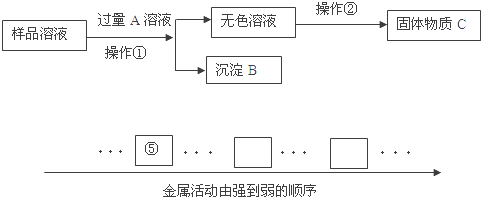
【题目】兴趣小组的同学学习了金属的性质后,在实验室找到的一种银白色金属R做如下探究:
(1)将金属R投入稀盐酸中,金属表面有气泡冒出.则该金属R在金属活动性顺序表中排在氢的 (选填“前面”或“后面”)。
(2)为了比较金属R与铁的活动性强弱,兴趣小组设计下列方案进行实验,请完成下表:
你的一种猜想 | 验证方法 | 现象 | 结论 |
金属R的活动性比铁 | 将金属R投入 溶液中 | 金属R表面有黑色的物质析出 | 猜想 (选填“正确”或“错误”) |
(3)请根据上述的信息,标出金属Fe、R、Cu在下列金属活动性顺序表中的相应位置。
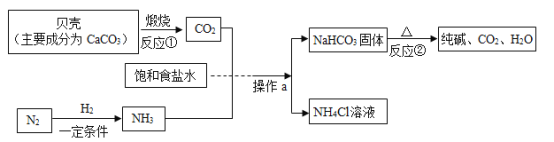
【题目】南京市国民经济和社会发展第“十二五”规划纲要指出,要做强做优电子信息等工业支柱产业.硅(Si)是信息技术的关键材料,常用以下方法制得纯硅,如下图所示:
![]()
(1)图中①、③发生了置换反应,②发生了化合反应.写出②和③的化学反应方程式:
②___________________;
③___________________.
(2)完成一种表示置换反应的通式:单质(I)+化合物(I)=单质(Ⅱ)+________.
根据已学知识填表:
单质(I) | 单质(Ⅱ) | 相应的置换反应的化学方程式(各举一例) | |
A | 金属 | 非金属 |
|
B | 金属(I) | 金属(Ⅱ) |
|
C | 非金属 | 金属 |
|
D |
|
|
|
【题目】为测定石灰石样品的纯度,取4g该样品,将40g稀盐酸平均分成4份,分4次加入到样品中,充分反应后测定剩余固体的质量,数据见下表。
次数 | 1 | 2 | 3 | 4 |
加入盐酸质量/g | 10 | 10 | 10 | 10 |
剩余固体质量/g | 2.5 | 1.0 | 0.4 | 0.4 |
(1)该石灰石样品中碳酸钙的质量分数是_____;
(2)求100g这种石灰石跟足量盐酸反应,生成二氧化碳的质量_____。