题目内容
 在高效复习课堂中,同学们利用“硝酸、氯化钡、氢氧化钾、硫酸镁”四种物质的溶液对“复分解反应发生的条件”进行再探究.
在高效复习课堂中,同学们利用“硝酸、氯化钡、氢氧化钾、硫酸镁”四种物质的溶液对“复分解反应发生的条件”进行再探究.
(1)根据复分解反应发生的条件判断上述物质中能与硫酸镁溶液发生反应的是(写化学式)______;
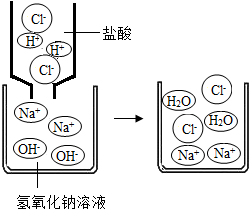
(2)如图是稀盐酸和氢氧化钠溶液发生化学反应的微观过程示意图,该化学反应的实质可以表示为:H++OH-=H2O上述四种溶液两两之间也能发生这种反应的是(写反应的化学方程式)______;
(3)用滴管向装有硫酸镁溶液和少量硝酸混合液的烧杯中慢慢滴入足量氢氧化钾溶液并不断搅拌,观察到的反应现象有______.
(4)用滴管向硫酸镁溶液中滴加甲溶液,有白色沉淀生成,再滴入乙溶液,沉淀溶解,则甲和乙分别是上述四种溶液中
的______和______.
解:(1)氯化钡能与硫酸镁溶液发生反应生成硫酸钡沉淀和氯化镁,氢氧化钾能与硫酸镁溶液发生反应生成氢氧化镁沉淀和硫酸钾,故答案为:BaCl2、KOH;
(2)氢氧化钾和硝酸反应的实质也是H++OH-=H2O,氢氧化钾与硝酸会反应生成硝酸钾和水,该反应的化学方程式为:KOH+HNO3═KNO3+H2O;故答案为:KOH+HNO3═KNO3+H2O;
(3)用滴管向装有硫酸镁溶液和少量硝酸混合液的烧杯中慢慢滴入足量氢氧化钾溶液并不断搅拌,氢氧化钾先和硝酸反应,无明显现象,然后再和硫酸镁反应生成氢氧化镁白色沉淀,故观察到的反应现象有一开始无明显现象,后来出现白色沉淀,故答案为:一开始无明显现象,后来出现白色沉淀;
(4)用滴管向硫酸镁溶液中滴加甲溶液,有白色沉淀生成,说明甲溶液是氯化钡溶液或氢氧化钾溶液,因为硫酸钡不溶于酸,氢氧化镁溶于酸,根据现象“再滴入乙溶液,沉淀溶解”可知甲是氢氧化镁,乙是硝酸,故答案为:氢氧化镁;硝酸.
分析:(1)根据复分解反应的条件进行分析,两种化合物相互交换成分能生成沉淀、气体或水,则反应能够进行,据此解答即可.
(2)根据酸碱反应的实质选择物质,从而书写化学方程式.
(3)根据物质间的相互反应分析实验现象.
(4)根据所给出物质间的相互反应进行分析.
点评:本题难度较大,掌握复分解反应的条件、酸碱盐之间的相互反应及其现象是解答本题的关键.
(2)氢氧化钾和硝酸反应的实质也是H++OH-=H2O,氢氧化钾与硝酸会反应生成硝酸钾和水,该反应的化学方程式为:KOH+HNO3═KNO3+H2O;故答案为:KOH+HNO3═KNO3+H2O;
(3)用滴管向装有硫酸镁溶液和少量硝酸混合液的烧杯中慢慢滴入足量氢氧化钾溶液并不断搅拌,氢氧化钾先和硝酸反应,无明显现象,然后再和硫酸镁反应生成氢氧化镁白色沉淀,故观察到的反应现象有一开始无明显现象,后来出现白色沉淀,故答案为:一开始无明显现象,后来出现白色沉淀;
(4)用滴管向硫酸镁溶液中滴加甲溶液,有白色沉淀生成,说明甲溶液是氯化钡溶液或氢氧化钾溶液,因为硫酸钡不溶于酸,氢氧化镁溶于酸,根据现象“再滴入乙溶液,沉淀溶解”可知甲是氢氧化镁,乙是硝酸,故答案为:氢氧化镁;硝酸.
分析:(1)根据复分解反应的条件进行分析,两种化合物相互交换成分能生成沉淀、气体或水,则反应能够进行,据此解答即可.
(2)根据酸碱反应的实质选择物质,从而书写化学方程式.
(3)根据物质间的相互反应分析实验现象.
(4)根据所给出物质间的相互反应进行分析.
点评:本题难度较大,掌握复分解反应的条件、酸碱盐之间的相互反应及其现象是解答本题的关键.

练习册系列答案
相关题目

 36、在高效复习课堂中,同学们利用“硫酸、硝酸钡、氢氧化钠、碳酸钾”四种物质的溶液对“复分解反应发生的条件”进行再探究.
36、在高效复习课堂中,同学们利用“硫酸、硝酸钡、氢氧化钠、碳酸钾”四种物质的溶液对“复分解反应发生的条件”进行再探究.
 在高效复习课堂中,同学们利用“硝酸、氯化钡、氢氧化钾、硫酸镁”四种物质的溶液对“复分解反应发生的条件”进行再探究.
在高效复习课堂中,同学们利用“硝酸、氯化钡、氢氧化钾、硫酸镁”四种物质的溶液对“复分解反应发生的条件”进行再探究.