题目内容
 36、在高效复习课堂中,同学们利用“硫酸、硝酸钡、氢氧化钠、碳酸钾”四种物质的溶液对“复分解反应发生的条件”进行再探究.
36、在高效复习课堂中,同学们利用“硫酸、硝酸钡、氢氧化钠、碳酸钾”四种物质的溶液对“复分解反应发生的条件”进行再探究.【知识回放】
通过判断上述四种溶液两两之间能否发生反应,我能写出其中符合下列条件的一个化学方程式:一个中和反应
H2SO4+2NaOH═Na2SO4+2H2O
;【挖掘实质】
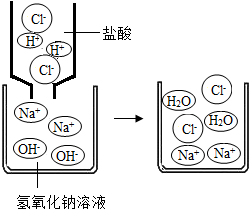
(1)图1是HCl和NaOH在水中解离出离子的示意图,小丽发现HCl在水中会解离出H+和Cl-,NaOH在水中会解离出Na+和OH-,以此类推硝酸钡在水中会解离出的离子是
Ba2+和NO3-
(填离子符号).(2)图2是稀盐酸和氢氧化钠溶液发生化学反应的微观过程示意图,该化学反应的实质可以表示为H++OH-=H2O
我也能用同样的方式表示上述四种溶液两两之间发生反应时有气体生成
2HCl+Na2CO3═2NaCl+H2O+CO2↑
的反应的实质2H++CO32-═H2O+CO2↑
【实践运用】
(1)通过上述探究发现,在溶液中H+和OH-不能大量共存,我还发现在溶液中
Ba2+
和SO42-
(填离子符号,下同)也不能大量共存.(2)利用上述四种物质的溶液完成实验后,将所得物质混合并过滤,得到一种无色溶液.经测定,该溶液显酸性.则在该溶液中一定含有的离子是
H+、Na+、K+和NO3-
.为了验证该溶液中可能含有的离子是否存在,我设计如下实验进行验证.| 溶液中可能含有的离子 | 设计实验验证 | ||
| 实验步骤 | 现象 | 结论 | |
对“复分解反应发生的条件”的再探究,我发现在分析多种溶液混合后所得溶液中离子的成分时,应考虑的因素是
溶液中的离子能否大量共存
.分析:【知识回放】写出一个中和反应H2SO4+2NaOH═Na2SO4+2H2O
【挖掘实质】小丽发现HCl在水中会解离出H+和Cl-,以此类推硝酸钡在水中会解离出的离子是Ba2+和NO3-;图2是稀盐酸和氢氧化钠溶液发生化学反应的微观过程示意图,该化学反应的实质可以表示为H++OH-=H2O我也能用同样的方式表示上述四种溶液两两之间发生反应时有气体生成 2HCl+Na2CO3═2NaCl+H2O+CO2↑;该反应的实质:2H++CO32-═H2O+CO2↑
【实践运用】通过上述探究发现,在溶液中H+和OH-不能大量共存,我还发现在溶液中Ba2+和SO42-也不能大量共存;利用上述四种物质的溶液完成实验后,将所得物质混合并过滤,得到一种无色溶液.经测定,该溶液显酸性.则在该溶液中一定含有的离子是H+、Na+、K+和NO3-
【知识升华】溶对“复分解反应发生的条件”的再探究,我发现在分析多种溶液混合后所得溶液中离子的成分时,应考虑的因素是:液中的离子能否大量共存.
【挖掘实质】小丽发现HCl在水中会解离出H+和Cl-,以此类推硝酸钡在水中会解离出的离子是Ba2+和NO3-;图2是稀盐酸和氢氧化钠溶液发生化学反应的微观过程示意图,该化学反应的实质可以表示为H++OH-=H2O我也能用同样的方式表示上述四种溶液两两之间发生反应时有气体生成 2HCl+Na2CO3═2NaCl+H2O+CO2↑;该反应的实质:2H++CO32-═H2O+CO2↑
【实践运用】通过上述探究发现,在溶液中H+和OH-不能大量共存,我还发现在溶液中Ba2+和SO42-也不能大量共存;利用上述四种物质的溶液完成实验后,将所得物质混合并过滤,得到一种无色溶液.经测定,该溶液显酸性.则在该溶液中一定含有的离子是H+、Na+、K+和NO3-
| 溶液中可能含有的离子 | 设计实验验证(实验步骤、现象及对应的结论) |
| 可能性一:Ba2+(同时答两种或两种以上离子的不得分,下同.) | 取上述溶液少量于试管中,加入少量硫酸钠溶液.若出现白色沉淀,则说明上述溶液中含有Ba2+;若没有出现白色沉淀,则说明上述溶液中不含有Ba2+. |
| 可能性二:SO42- | 取上述溶液少量于试管中,加入少量硝酸钡溶液.若出现白色沉淀,则说明上述溶液中含有SO42-;若没有出现白色沉淀,则说明上述溶液中不含有SO42-. |
| 可能性三:Ba2+或SO42- | 取上述溶液少量于试管中,加入少量硫酸钠溶液.若出现白色沉淀,则说明上述溶液中含有Ba2+,不含有SO42-.(若没有出现白色沉淀,必须验证SO42-)(其他答案合理给分.) |
解答:解:【知识回放】我能写出其中符合下列条件的一个化学方程式:一个中和反应H2SO4+2NaOH═Na2SO4+2H2O
【挖掘实质】小丽发现HCl在水中会解离出H+和Cl-,NaOH在水中会解离出Na+和OH-,以此类推硝酸钡在水中会解离出的离子是Ba2+和NO3-;图2是稀盐酸和氢氧化钠溶液发生化学反应的微观过程示意图,该化学反应的实质可以表示为H++OH-=H2O我也能用同样的方式表示上述四种溶液两两之间发生反应时有气体生成 2HCl+Na2CO3═2NaCl+H2O+CO2↑;该反应的实质:2H++CO32-═H2O+CO2↑
【实践运用】通过上述探究发现,在溶液中H+和OH-不能大量共存,我还发现在溶液中Ba2+和SO42-也不能大量共存;利用上述四种物质的溶液完成实验后,将所得物质混合并过滤,得到一种无色溶液.经测定,该溶液显酸性.则在该溶液中一定含有的离子是H+、Na+、K+和NO3-
【知识升华】溶对“复分解反应发生的条件”的再探究,我发现在分析多种溶液混合后所得溶液中离子的成分时,应考虑的因素是:液中的离子能否大量共存或者离子是否参加化学反应,参加化学反应的离子是否有剩余.
故答案为:【知识回放】(1)H2SO4+2NaOH═Na2SO4+2H2O
【挖掘实质】Ba2+和NO3-;2HCl+Na2CO3═2NaCl+H2O+CO2↑;2H++CO32-═H2O+CO2↑
【实践运用】Ba2+和SO42-;H+、Na+、K+和NO3-
【知识升华】溶液中的离子能否大量共存或者离子是否参加化学反应,参加化学反应的离子是否有剩余.
【挖掘实质】小丽发现HCl在水中会解离出H+和Cl-,NaOH在水中会解离出Na+和OH-,以此类推硝酸钡在水中会解离出的离子是Ba2+和NO3-;图2是稀盐酸和氢氧化钠溶液发生化学反应的微观过程示意图,该化学反应的实质可以表示为H++OH-=H2O我也能用同样的方式表示上述四种溶液两两之间发生反应时有气体生成 2HCl+Na2CO3═2NaCl+H2O+CO2↑;该反应的实质:2H++CO32-═H2O+CO2↑
【实践运用】通过上述探究发现,在溶液中H+和OH-不能大量共存,我还发现在溶液中Ba2+和SO42-也不能大量共存;利用上述四种物质的溶液完成实验后,将所得物质混合并过滤,得到一种无色溶液.经测定,该溶液显酸性.则在该溶液中一定含有的离子是H+、Na+、K+和NO3-
| 溶液中可能含有的离子 | 设计实验验证(实验步骤、现象及对应的结论) |
| 可能性一:Ba2+(同时答两种或两种以上离子的不得分,下同.) | 取上述溶液少量于试管中,加入少量硫酸钠溶液.若出现白色沉淀,则说明上述溶液中含有Ba2+;若没有出现白色沉淀,则说明上述溶液中不含有Ba2+. |
| 可能性二:SO42- | 取上述溶液少量于试管中,加入少量硝酸钡溶液.若出现白色沉淀,则说明上述溶液中含有SO42-;若没有出现白色沉淀,则说明上述溶液中不含有SO42-. |
| 可能性三:Ba2+或SO42- | 取上述溶液少量于试管中,加入少量硫酸钠溶液.若出现白色沉淀,则说明上述溶液中含有Ba2+,不含有SO42-.(若没有出现白色沉淀,必须验证SO42-)(其他答案合理给分.) |
故答案为:【知识回放】(1)H2SO4+2NaOH═Na2SO4+2H2O
【挖掘实质】Ba2+和NO3-;2HCl+Na2CO3═2NaCl+H2O+CO2↑;2H++CO32-═H2O+CO2↑
【实践运用】Ba2+和SO42-;H+、Na+、K+和NO3-
| 溶液中可能含有的离子 | 设计实验验证(实验步骤、现象及对应的结论) |
| 可能性一:Ba2+(同时答两种或两种以上离子的不得分,下同.) | 取上述溶液少量于试管中,加入少量硫酸钠溶液.若出现白色沉淀,则说明上述溶液中含有Ba2+;若没有出现白色沉淀,则说明上述溶液中不含有Ba2+. |
| 可能性二:SO42- | 取上述溶液少量于试管中,加入少量硝酸钡溶液.若出现白色沉淀,则说明上述溶液中含有SO42-;若没有出现白色沉淀,则说明上述溶液中不含有SO42-. |
| 可能性三:Ba2+或SO42- | 取上述溶液少量于试管中,加入少量硫酸钠溶液.若出现白色沉淀,则说明上述溶液中含有Ba2+,不含有SO42-.(若没有出现白色沉淀,必须验证SO42-)(其他答案合理给分.) |
点评:本题考查复分解反应及其反应条件.是化学中四大基本反应类型之一.它的概念是两种化合物互相交换成分,生成两种新的化合物的反应.沉淀、气体、水是复分解反应发生的条件.

练习册系列答案
 应用题作业本系列答案
应用题作业本系列答案
相关题目


 在高效复习课堂中,同学们利用“硝酸、氯化钡、氢氧化钾、硫酸镁”四种物质的溶液对“复分解反应发生的条件”进行再探究.
在高效复习课堂中,同学们利用“硝酸、氯化钡、氢氧化钾、硫酸镁”四种物质的溶液对“复分解反应发生的条件”进行再探究.