题目内容
【题目】(13分)生活处处皆化学。
(1)金属在生活中用途广泛
①下列生活用品,主要是由金属材料制成的是 ;

②用铁锅烹饪食物时,会增加食物中的铁元素。请你写出一个厨房中防止铁锅生锈的方法 。
(2)生活中的水和溶液
①二氧化氯是一种新型的消毒剂,二氧化氯中氯元素的化合价为 ;
②欲配制500mL 0.9%的生理盐水(密度为1.0 g/mL),需要NaCl的质量为 g;配制过程中,玻璃棒的作用是 。
经检测,所配生理盐水的溶质质量分数偏小,其原因可能有 (填序号);
A.氯化钠固体不纯
B.称量时砝码端忘垫质量相同的纸片
C.量取水时,俯视读数
D.装瓶时,有少量溶液洒出
③下图是净化河水的简易装置,下列说法正确的是 ;
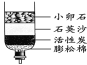
A.净化后的水是纯净物 B.此装置能对水杀菌消毒
C.此装置能把硬水变为软水 D.活性炭能吸附水中的色素及异味
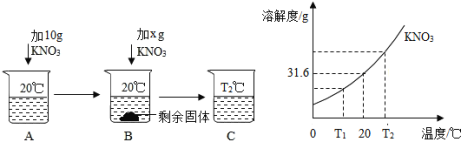
④KNO3可用作配制无土栽培营养液,下表提供了KNO3在不同温度时的溶解度:
温度/℃ | 0 | 20 | 40 | 60 | 80 |
溶解度/g | 13.3 | 31.6 | 63.9 | 110 | 169 |
a.20℃时,将10gKNO3加入50g水中充分溶解,所得溶液的质量为 g,
b.现有60℃时的KNO3饱和溶液210 g,降温至20℃,会析出KNO3 g,
c.某同学用10%的KNO3溶液作营养液,则该营养液中氧元素的质量分数为 。
【答案】(1)① AC ② 用后洗净烘干
(2)① +4 ② 4.5g 加快溶解速率 AB
③ D ④ a. 60 b. 78.4 c.约84.8%
【解析】
试题分析:(1)金属材料包括纯金属和合金,故AC属金属材料;铁生锈的条件是与氧气和水同时接触,防止铁生锈的原理就是破坏铁生锈的条件,故方法有用后洗净烘干等;
(2)根据“在化合物中,正负化合价的代数和为零”的原则,已知O的化合价为-2价,设氯元素的化合价为x,则x+(-2)×2=0,解得x=+4;氯化钠的质量=500mL×1.0 g/mL×0.9%=4.5g;溶解时要用玻璃棒目的是加快氯化钠的溶解速率;溶质的质量分数=溶质的质量÷溶液的质量,所配生理盐水的溶质质量分数偏小,可能的原因是氯化钠固体不纯或称量时砝码端忘垫质量相同的纸片或量取水时,仰视读数;右图是净化河水的简易装置中只能起过滤和吸附的作用,得到的水仍是混合物;降低水硬度的方法有蒸馏和煮沸;
④20℃时,KNO3的溶解度是31.6g,即100g水中要溶解31.6g硝酸钾达到饱和状态,那么50g水中可以溶解15.8g硝酸钾,故20℃时,将10gKNO3加入50g水中充分溶解得到的是不饱和溶液,所得溶液的质量为60g;60℃时的KNO3的溶解度是110g,即1oog水中溶解110g硝酸钾达到饱和状态,现有KNO3饱和溶液210 g,那么溶质的质量为110g,20℃时,KNO3的溶解度是31.6g,故析出晶体的质量为110g-31.6g=78.4g;
设10%的KNO3溶液的质量为100g,那么溶质硝酸钾的质量为10g,溶剂水的质量为90g,10g硝酸钾中氧元素的质量为10g×48/101 ×100%=4.75g,90g水中氧元素的质量=90g×16/18 ×100%=80g,那么营养液中氧元素的质量分数=(4.75g+80g)/100g ×100%=84.8%。

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案