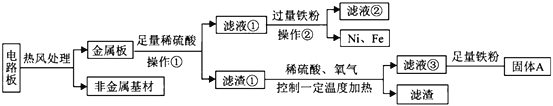
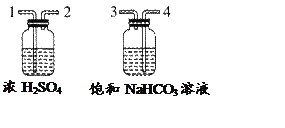题目内容
【题目】甲、乙两个实验小组分别进行“测定Na2CO3和NaCl混合物中Na2CO3含量的实验。
(1)甲组:沉淀分析法
把一定量的混合物溶解后加入过量CaCl2,然后将所得沉淀过滤、洗涤、烘干、称量。确定CaCl2溶液是否过量的方法是________________;洗涤沉淀并判断沉淀是否洗净的操作是_______________。
(2)乙组:气体分析法
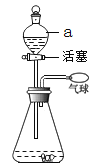
把一定量的混合物与足量盐酸反应后,用如图装置测定产生的CO2气体的体积,为减小CO2的溶解,B中溶液应是_________________,选用该溶液后实验结果还是不准确,原因是_________________。
(3)请你设计一个与甲、乙两组操作不同的实验方案,测定混合物中Na2CO3的含量。
方法:_________________。
用到的主要试剂:_____________________(至少2种)。
用到的玻璃仪器:_________________(至少2件)。
【答案】 取少量的上层清液加入碳酸钠溶液,若变浑浊则CaCl2过量 取最后一次洗涤液,加入硝酸银溶液后若不变浑浊则洗净 NaHCO3溶液 因为从A制备出的气体中含有HCl,和碳酸氢钠反应会生成二氧化碳,导致测定结果不准确 利用混合物中的氯化钠反应生成氯化银沉淀,测定氯化银的沉淀质量计算氯化钠质量得到样品中碳酸钠的质量分数 HNO3和AgNO3 烧杯、玻璃棒、漏斗
【解析】(1)沉淀法是利用碳酸钠能与氯化钙反应生成碳酸钙沉淀和氯化钠,Na2CO3+CaCl2═CaCO3↓+2NaCl,称量沉淀质量,依据碳酸根离子物质的量为碳酸钠物质的量计算得到;加入沉淀试剂氯化钙过量目的是完全沉淀碳酸根离子,确定CaCl2溶液是否过量的方法是取少量的上层清液加入碳酸钠溶液,若变浑浊则CaCl2过量;沉淀表面有氯化钠溶液,判断沉淀是否洗净的操作是取最后一次洗涤液,加入硝酸银溶液后若不变浑浊则洗净;(3)依据装置图分析,气体法是利用加入的稀盐酸和碳酸钠反应生成二氧化碳气体,利用排液法测定二氧化碳的体积,为减小CO2的溶解,装置中B中的液体需要减小二氧化碳溶解,选择饱和碳酸氢钠溶液,即使通过饱和碳酸氢钠溶液,因为制备气体中含有HCl,和碳酸氢钠反应会生成二氧化碳,导致测定结果不准确;(3)可以利用混合物中的氯化钠反应生成氯化银沉淀,测定氯化银的沉淀质量计算氯化钠质量得到样品中碳酸钠的质量分数;把一定量的混合物溶解后加入足量的HNO3,再加AgNO3过滤洗涤烘干称量,用到试剂是HNO3和AgNO3;实验操作过程中需要用到反应后过滤得到沉淀继续称量,玻璃仪器有烧杯、玻璃棒、漏斗。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】小明进行H2O2溶液制O2的实验探究。结合下列过程,回答有关问题。
(1)MnO2作催化剂,向5mL5%的H2O2溶液中加入少量MnO2,立即产生大量气泡。
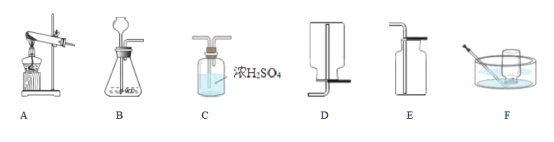
①写出用H2O2溶液制备O2的化学方程式:____________________________________。
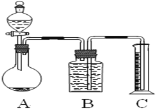
②用上述反应原理制备并收集一瓶干燥的O2,从所给装置图中选择并组装一套装置,其连接顺序为_______→ __________→ ________(填标号)。为了确保实验成功,在装药品之前应该_________。
③检验O2的方法是___________________________ ,若木条复燃,则证明收集的气体为O2。
(2)FeCl3溶液做催化剂
向5mL5%的H2O2溶液中加入2滴一定浓度的 FeCl3溶液,立即产生大量气泡。
(已知)FeCl3溶液中主要含有三种微粒:H2O、Fe3+、Cl-
(问题)那种微粒对H2O2溶液的分解起催化作用?
(假设)假设一:可能是H2O
假设二:可能是Fe3+
假设三:可能是Cl-
(分析)①假设一不可能成立,理由是__________________________________________。
(实验)
操作 | 现象 |
其他条件不变,向H2O2溶液中加入NaCl溶液 | 无明显变化 |
其他条件不变,向H2O2溶液中加入Na2SO4溶液 | 无明显变化 |
其他条件不变,向H2O2溶液中加入Fe2(SO4)3溶液 | 立即产生大量气泡 |
(结论)②假设___成立,而假设一和另一种假设不成立。
③催化剂比较从循环利用的角度分析,_____(填化学式)更适合做该反应的催化剂。