题目内容
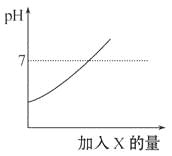
【题目】从宏观、微观和量的角度描述化学反应是化学特有的方式。下面是对稀盐酸与氢氧化钠反应的不同描述。图A是实际操作图,图B是微观粒子结合过程的图示,图C是反应过程中溶液的酸碱度变化曲线。根据要求回答下列问题:
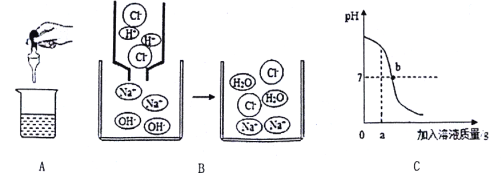
(1)该变化对应的实验操作是将_______滴加到另一种溶液中;
(2)当滴入溶液的质量为ag时,溶液中溶质为______(填化学式);
(3)b点溶液中主要的离子是_____(填离子符号);
(4)该反应的实质是______
【答案】稀盐酸 NaOH、NaCl Na+、Cl- H++OH-=H2O
【解析】
(1)图C中pH是逐渐减小的,因此是把稀盐酸滴入氢氧化钠溶液中;
(2)当滴入溶液的质量为ag时,溶液的pH>7,氢氧化钠过量,溶液中的溶质为氯化钠和氢氧化钠,化学式为:NaOH、NaCl;
(3)b点溶液pH=7,当溶液的pH=7时,氢氧化钠和盐酸恰好完全反应,溶液中的主要离子是钠离子和氯离子,化学式为:Na+、Cl-;
(4)中和反应的实质是氢离子和氢氧根离子反应生成水的过程,表示为:H++OH-=H2O。

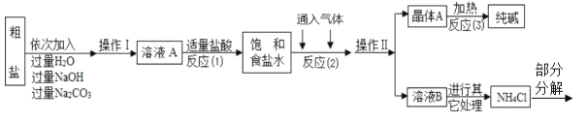
【题目】溶液与人们的生活息息相关。
(1)下列少量物质分别放入水中,充分搅拌,可以得到溶液的是______(填字母)。
A.高锰酸钾 B.汽油 C.面粉
(2)下表是三种物质在不同温度时的溶解度,根据表中信息回答问题。
温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 | |
溶解度/g | 氯化钠 | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 | 39.8 |
硝酸钾 | 13.3 | 31.6 | 63.9 | 110 | 169 | 246 | |
氢氧化钙 | 0.19 | 0.17 | 0.14 | 0.12 | 0.09 | 0.08 | |
①60℃时,氯化钠的溶解度_______硝酸钾的济解度(填“>”“=”或“<”)。
②向20℃的氢氧化钙饱和溶液中加入少量生石灰,再冷却至20℃,此时溶液中溶质的质量比加入生石灰前溶液中溶质的质量____(填“增大”“不变”或“减小”)。
③混有少量氯化钠的硝酸钾固体,加水配成80℃的硝酸钾饱和溶液,再冷却至20℃,析出晶体并得到溶液。下列有关说法中正确的是_______(填字母)。
A.析出的晶体中不一定含有硝酸钾
B.所得溶液一定是硝酸钾饱和溶液
C.上述方法可以将两种物质完全分离
(3)如图所示为X、Y、Z三种固体物质(不含结晶水)的溶解度曲线,请回答下列问题:
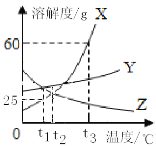
①t3℃时,溶质质量分数为25%的X溶液降温到t1℃,所得溶液中溶质质量分数是________。
②t3℃时,等质量X、Y、Z的饱和溶液分别降温到t1℃,溶液质量没有变化的是_______。
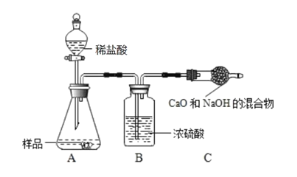
【题目】根据以下实验内容,回答相关问题。
[实验目的]证明氢氧化钠溶液与稀盐酸发生了反应且生成了新物质;
[实验原理]____________(用化学方程式表示);
[药品仪器]
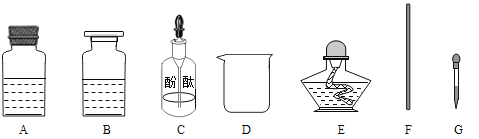
[实验步骤]
①取_______(选填“A”或“B”)中试剂加入至D中,滴加2滴酚酞试液,溶液呈红色;
②用_______(填图中仪器对应字母)向①中溶液滴加稀盐酸,直至红色消失;
③向②中溶液继续滴加过量稀盐酸,溶液保持无色:
④用F蘸取③中溶液,在酒精灯上灼烧,有白色固体产生。
[思考拓展](1)步骤③的目的是____________;
(2)如不使用酸碱指示剂,进一步确认步骤④中的白色固体不是氢氧化钠的方法是_____________;
(3)已知酚酞试液在不同pH时的变色情况如下表。
pH | <8.2 | 8.2~10.0 | >10.0 |
颜色 | 无色 | 红色 | 无色 |
某同学发现:向某氢氧化钠溶液中滴加酚酞试液后溶液显无色;逐滴加稀盐酸,溶液先变红,后褪至无色。你认为该氢氧化钠溶液滴加酚酞试液显无色的原因可能是_________;请设计实验证明你的精想(写出简要的操作步骤与现象)_________________。
【题目】装修材料的大理石,主要成分是![]() ,某同学为了测定大理石中碳酸钙的质量分数进行了如下实验。取定量的大理石样品(研碎)放入盛有100g稀盐酸的烧杯中,大理石样品、稀盐酸和烧杯的总质量为140g克(烧杯的质量为25g)。在化学反应过程中对烧杯及其中的剩余物进行了五次称量,记录数据如下表(假设反应匀速进行,杂质不与稀盐酸反应,产生的气体均能全部逸出),请计算:
,某同学为了测定大理石中碳酸钙的质量分数进行了如下实验。取定量的大理石样品(研碎)放入盛有100g稀盐酸的烧杯中,大理石样品、稀盐酸和烧杯的总质量为140g克(烧杯的质量为25g)。在化学反应过程中对烧杯及其中的剩余物进行了五次称量,记录数据如下表(假设反应匀速进行,杂质不与稀盐酸反应,产生的气体均能全部逸出),请计算:
反应时间/s | 20 | 40 | 60 | 80 | 100 |
烧杯和药品质量/g | 137.8 | 135.6 | m | 134.5 | 134.5 |
(1)表中的“m”为______g;
(2)该石灰石样品中碳酸钙的质量分数_____。(计算结果精确至0.1%)