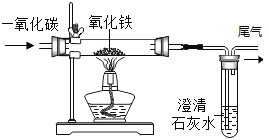
题目内容
【题目】甲、乙两种物质的溶解度曲线如图所示,下列说法正确的是( )
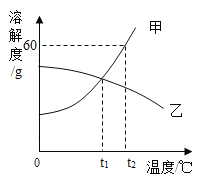
A.甲物质的溶解度大于乙物质的溶解度
B.t2℃时,甲的饱和溶液的溶质质量分数为60%
C.t1℃时,甲、乙饱和溶液的溶质质量分数相等
D.将t2℃时甲、乙的饱和溶液降温至t1℃,所得溶液的溶质质量分数一定相同
【答案】C
【解析】
A、当温度大于t1时,甲物质的溶解度大于乙物质的溶解度,故错误;
B、t2℃时,甲的溶解度为60g,那么甲的饱和溶液的溶质质量分数为![]() 60%,故错误;
60%,故错误;
C、t1℃时,甲、乙的溶解度相等,则饱和溶液的溶质质量分数相等,故C正确;
D、将t2℃时,甲的溶解度大于乙,其饱和溶液降温至t1℃,根据溶解度曲线,甲没有晶体析出,乙有晶体析出,则所得溶液的溶质质量分数甲大于乙,故错误。
故选C

 名校课堂系列答案
名校课堂系列答案【题目】小明在科教频道节目中了解到水冲压发动机是一种新型动力装置,其主要原理是应用金属镁与热水能发生化学反应。那么镁与水反应的快慢与哪些因素有关呢?小明和同学们一起对此展开了探究。
(查阅资料)
①氯化铵能与氢氧化镁反应产生氨气、水、氯化镁2NH4Cl+Mg(OH)2═MgCl2+2NH3↑+2H2O
②浓硫酸能吸收氨气,且不产生其他气体。
(提出问题)镁与水反应的快慢与哪些因素有关呢?
(建立猜想)①镁与水反应的快慢可能与反应物的温度有关。
②_____________
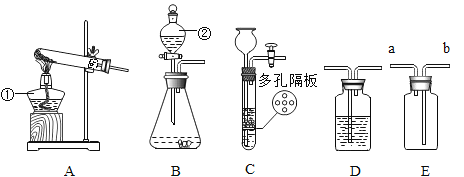
(实验探究)小明验证猜想①按照甲图装置进行实验(恒温器内可保持温度恒定)
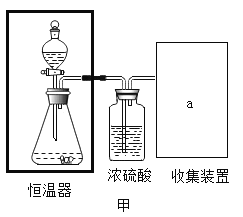
在甲图的锥形瓶和分液漏斗中,分别加入等量的镁条和蒸馏水,改变反应物温度,并记录如下表:
反应物温度(℃) | 50 | 55 | 60 | 65 | 70 |
收集50mL氢气所用时间(秒) | 295 | 257 | 196 | 124 | 74 |
(反思与总结)
(1)本实验是通过观察_____________来判断镁与水反应的快慢。
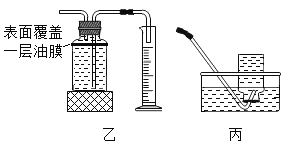
(2)乙、丙两图均属于收集装置,本实验a处收集装置应选用____________。(选填乙或丙)表面覆盖一层油膜的目的______________;金属镁能与热水反应生成氢氧化镁和氢气化学方程式___________。
(3)一段时间后,小明观察到镁条(镁条和热水均有剩余)表面无气泡产生,即反应停止了。但加入少量氯化铵溶液后,镁条表面又冒出气泡,且收集装置中的气体体积继续增加。解释“镁与热水反应一段时间后会停止,但加入氯化铵溶液后,镁与水的反应会继续进行”现象的原因是___________。