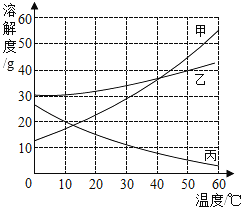
题目内容
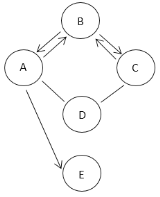
【题目】A、B、C、D、E它们均为初中化学常见物质,有酸、碱、盐和氧化物,它们的部分反应和转化关系如图所示(“一”表示两种物质能发生反,“![]() ”表示一种物质能转化成另一种物质,且省略部分反应物或生成物及关系),已知A、B,C均含有相同阴离子,C的溶液为蓝色,E为生活中最常见的液体,根据信息回答下列问题:
”表示一种物质能转化成另一种物质,且省略部分反应物或生成物及关系),已知A、B,C均含有相同阴离子,C的溶液为蓝色,E为生活中最常见的液体,根据信息回答下列问题:
(1)物质B的化学式为_______;
(2)A、B两种物质相互转化的化学方程式为:_________。
(3)C、D两种物质反应的实验现象是: ____________。
【答案】Ba(NO3)2 2HNO3+ Ba(OH)2=Ba(NO3)2+2H2O;Ba(NO3)2+H2SO4= BaSO4![]() + 2HNO3 有蓝色沉淀产生,溶液由蓝色变为无色(或变浅)
+ 2HNO3 有蓝色沉淀产生,溶液由蓝色变为无色(或变浅)
【解析】
由题意知A、B,C均含有相同阴离子,C的溶液为蓝色,可推测C为硝酸铜;E为生活中最常见的液体,可推测E为水,属于氧化物;则B含有硝酸根,且能与C相互转化,可以推测B为硝酸钡;A也有硝酸根,可以推测A为硝酸;能与硝酸铜C反应,又能与硝酸A反应,可以推测D为碱,常见的碱为氢氧化钠,硝酸能与碱(金属氧化物)反应生成水;带入图中,推测成立。
(1)根据分析得,物质B的化学式为硝酸钡;故填:Ba(NO3)2
(2)A为硝酸,B为硝酸钡,硝酸转化为硝酸钡的方程式为:2HNO3+ Ba(OH)2=Ba(NO3)2+2H2O;硝酸钡转化为硝酸的化学方程式为:Ba(NO3)2+H2SO4= BaSO4![]() + 2HNO3;故填:2HNO3+ Ba(OH)2=Ba(NO3)2+2H2O;Ba(NO3)2+H2SO4= BaSO4
+ 2HNO3;故填:2HNO3+ Ba(OH)2=Ba(NO3)2+2H2O;Ba(NO3)2+H2SO4= BaSO4![]() + 2HNO3
+ 2HNO3
(3)C是硝酸铜,D是氢氧化钠,反应生成氢氧化铜沉淀和硝酸钠,反应的实验现象是: 有蓝色沉淀产生,溶液由蓝色变为无色(或变浅)。故填:有蓝色沉淀产生,溶液由蓝色变为无色(或变浅)

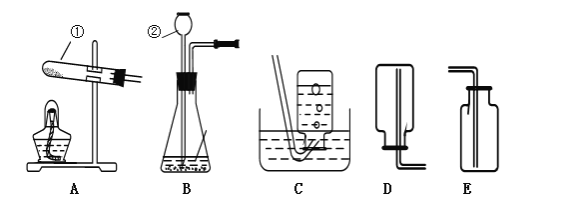
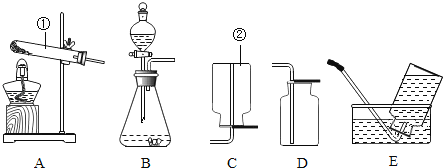
【题目】(探究一)利用如图所示的实验装置制备常见气体,请回答有关问题:
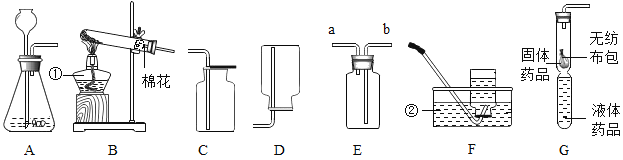
(1)写出标有序号的仪器名称:①_____.②_____.
(2)装置B为气体发生装置,在试管内放入一种暗紫色固体粉末制取氧气以制取氧气,写出有关反应的化学方程式_____.收集装置为_____.
(3)用装置E收集氧气,验满时将带火星的木条放在_____ (选填“a”或“b”)处.
(4)装置G是用软塑料管自制的气体发生装置,利用该装置也可以制取氧气,塑料管中加入的液体药品是_____,药品加入完毕后,要使反应进行,接下来的操作是:_____.
(探究二)探究氧化铁是否像二氧化锰一样可作氯酸钾分解的催化剂同学们设计了三组实验(其他可能影响因素均控制相同):
实验编号 | 实验药品 | 分解温度(℃) |
实验④ | 1.2g KClO3 | T1 |
实验⑤ | 1.2g KClO3、0.5g MnO2 | T2 |
实验⑥ | 1.2g KClO3、0.5g Fe2O3 | T3 |
(1)请写出氯酸钾在二氧化锰催化下制取氧气的化学方程式:_____
(2)若T3_____ (选填“>”、“=”或“<”)T1,说明氧化铁能加快氯酸钾的分解.
(3)若要比较氧化铁与二氧化锰对氯酸钾分解的催化效果,除了可以通过用比较T3与T2的大小,还可以通过排水法收集氧气,测量_____ 进行比较,得出结论.