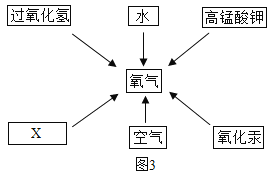
题目内容
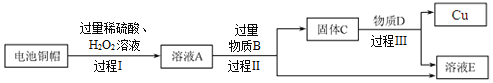
【题目】某化工厂在生产过程中的烟气通常含二氧化硫,在排放前需经脱硫处理,如图是两种常用脱硫工艺中含硫物质的转化路径(己知Na2SO3、CaSO3的化学性质与Na2CO3,CaCO3类似,CaSO3难溶于水,部分产物已略)
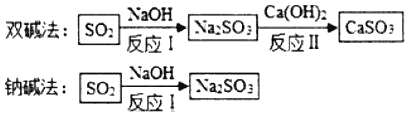
(1)写出上述工艺中氧化物的名称_____。
(2)双碱法中的“双碱”的阴离子符号_____。
(3)上述物质中能和稀盐酸反应的物质有_____种。
(4)已知部分原料的价格如表所示,两种工艺中,处理相同量的SO2,双碱法所需的原料成本更低,原因是_____。
试剂 | Ca(OH)2 | NaOH |
价格(元/kg) | 0.55 | 3.2 |
【答案】二氧化硫 OH﹣ 4 通过反应II实现了NaOH的循环利用,减少了NaOH的用量,且氢氧化钙价格便宜,所以成本降低
【解析】
(1)氧化物是由两种元素组成的化合物,且其中一种元素是氧元素,所以上述工艺中氧化物是SO2,读作二氧化硫;故填:二氧化硫;
(2)根据题中信息可知:双碱法中的“双碱”指的是Ca(OH)2和NaOH;其中的阴离子是氢氧根离子;故填:OH﹣;
(3)上述物质中的氢氧化钠和氢氧化钙均属于碱,能与盐酸反应;亚硫酸钠和亚硫酸钙均属于亚硫酸盐,也能与盐酸反应;故填:4;
(4)两种工艺中,处理相同量的SO2,双碱法所需的原料成本更低,原因是通过反应II实现了NaOH的循环利用,减少了NaOH的用量,且氢氧化钙价格便宜,所以成本降低。
故填:通过反应II实现了NaOH的循环利用,减少了NaOH的用量,且氢氧化钙价格便宜,所以成本降低。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目