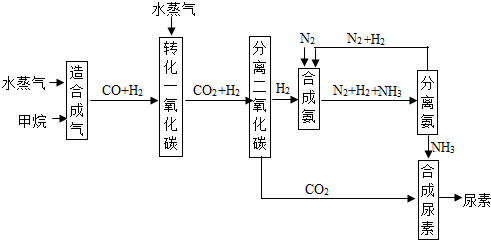
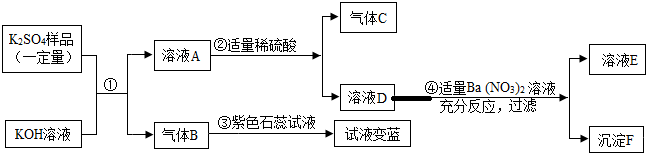
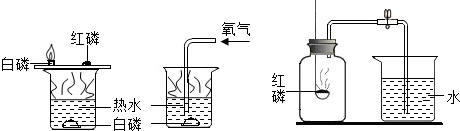
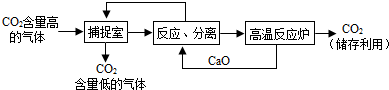
题目内容
(2013?南京)在密闭容器中有甲、乙、丙、丁四种物质,在一定条件下充分反应,测得反应前后各物质的质量分数如图所示:下列说法正确的是( )


分析:反应后质量增加的物质是生成物,反应后质量减少的物质是反应物,反应前后质量不变的物质可能是催化剂,也可能既不是反应物,也不是生成物,也不是催化剂.
解答:解:反应前后容器中物质的总质量不变,反应后质量分数减小的物质是反应物,质量分数增大的物质是生成物,由图中物质的质量分数的变化可知,甲和乙的质量分数减小,是反应物,丙物质的质量分数增大,是生成物,而丁物质的质量分数不变,丁物质可能是催化剂;
A、由以上分析可知,甲和乙物质反应生成了丙物质,属于化合反应,丙物质属于化合物.错误.
B、研究表明,有些催化剂在反应过程中参加了化学反应,如果丁物质是催化剂,也可能参与了化学反应.错误.
C、反应物是两种,生成物是一种,属于化合反应.正确.
D、应该是参加反应的甲和乙的质量之和一定等于生成丙的质量,甲物质和乙物质没有完全反应.错误.
故选:C.
A、由以上分析可知,甲和乙物质反应生成了丙物质,属于化合反应,丙物质属于化合物.错误.
B、研究表明,有些催化剂在反应过程中参加了化学反应,如果丁物质是催化剂,也可能参与了化学反应.错误.
C、反应物是两种,生成物是一种,属于化合反应.正确.
D、应该是参加反应的甲和乙的质量之和一定等于生成丙的质量,甲物质和乙物质没有完全反应.错误.
故选:C.
点评:理解质量守恒定律时,要注意是参加反应的物质的质量等于反应后生成的物质的质量,没有参与反应的那部分物质的质量不能计算在内.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
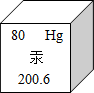 (2013?南京)在元素周期表中汞元素的某些信息如图所示,下列有关汞的说法正确的是( )
(2013?南京)在元素周期表中汞元素的某些信息如图所示,下列有关汞的说法正确的是( )