题目内容
(2013?南京二模)(1)銨磷钾是根据实际需要加工配制的复合肥料,因为它同时含有氮、
(2)如图实验:
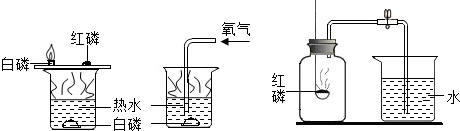
①磷燃烧的化学反应方程式
②该实验是通过控制哪些因素来探究可燃物燃烧的条件?
(3)①甲同学:点燃红磷立即伸入瓶中并塞上瓶塞.待红磷燃烧停止并冷却后,打开止水夹,观察到集气瓶中吸入水的体积约占集气瓶空气体积的
②乙同学:用碳替代红磷,完成上述实验,发现集气瓶内并没有吸入水,其原因是
③丙同学:向集气瓶中加入少量的氢氧化钠溶液,然后完成乙同学的实验,他认为能得到与甲同学相同的实验结果了.你认为呢?(说出理由)
(4)“碳捕捉技术”是指通过一定的方法,将工业生产中产生的CO2分离出来进行储存和利用.常利用NaOH溶液来“捕捉”CO2,过程如下图所示(部分条件及物质未标出).
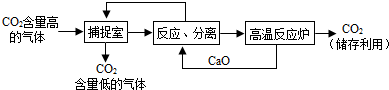
①NaOH溶液“捕捉”CO2的化学反应方程式为
②整个过程中,可以循环利用的物质有
③将CO2压缩后贮藏于深海,CO2在深海中的溶解度比在通常情况下在水中的溶解度大,原因是
磷
磷
、钾
钾
三种营养元素.(2)如图实验:

①磷燃烧的化学反应方程式
4P+5O2
2P2O5
| ||
4P+5O2
2P2O5
;
| ||
②该实验是通过控制哪些因素来探究可燃物燃烧的条件?
可燃物是否与氧气接触,可燃物是否达到燃烧所需的温度
可燃物是否与氧气接触,可燃物是否达到燃烧所需的温度
(3)①甲同学:点燃红磷立即伸入瓶中并塞上瓶塞.待红磷燃烧停止并冷却后,打开止水夹,观察到集气瓶中吸入水的体积约占集气瓶空气体积的
1/5
1/5
;②乙同学:用碳替代红磷,完成上述实验,发现集气瓶内并没有吸入水,其原因是
碳燃烧生成物是二氧化碳气体,瓶内气压不变
碳燃烧生成物是二氧化碳气体,瓶内气压不变
③丙同学:向集气瓶中加入少量的氢氧化钠溶液,然后完成乙同学的实验,他认为能得到与甲同学相同的实验结果了.你认为呢?(说出理由)
不能,因为碳在氧气不足时燃烧生成一氧化碳,一氧化碳不溶于氢氧化钠溶液
不能,因为碳在氧气不足时燃烧生成一氧化碳,一氧化碳不溶于氢氧化钠溶液
(4)“碳捕捉技术”是指通过一定的方法,将工业生产中产生的CO2分离出来进行储存和利用.常利用NaOH溶液来“捕捉”CO2,过程如下图所示(部分条件及物质未标出).

①NaOH溶液“捕捉”CO2的化学反应方程式为
CO2+2NaOH=Na2CO3+H2O
CO2+2NaOH=Na2CO3+H2O
②整个过程中,可以循环利用的物质有
NaOH、CaO
NaOH、CaO
③将CO2压缩后贮藏于深海,CO2在深海中的溶解度比在通常情况下在水中的溶解度大,原因是
深海中压强大、温度低,气体(CO2)在水中的溶解度增大
深海中压强大、温度低,气体(CO2)在水中的溶解度增大
.分析:同时含有氮、磷、钾三种元素中的两种或两种以上的肥料称为复合肥;
书写化学方程式要注意规范性;
测定空气中氧气的含量时,消耗氧气的物质应该具有的性质是:和氧气反应的生成物是固体,不能是气体;
碳在氧气充足时,燃烧生成二氧化碳,在氧气不足时,燃烧生成一氧化碳;
气体的溶解度随着压强的升高而增大,随着温度的降低而增大.
书写化学方程式要注意规范性;
测定空气中氧气的含量时,消耗氧气的物质应该具有的性质是:和氧气反应的生成物是固体,不能是气体;
碳在氧气充足时,燃烧生成二氧化碳,在氧气不足时,燃烧生成一氧化碳;
气体的溶解度随着压强的升高而增大,随着温度的降低而增大.
解答:解:(1)銨磷钾中含有氮元素、钾元素和磷元素.
故填:磷;钾.
(2)①磷燃烧能够生成五氧化二磷,反应的化学反应方程式为:4P+5O2
2P2O5.
故填:4P+5O2
2P2O5.
②该实验中,主要通过控制可燃物是否与氧气接触,温度是否达到可燃物的着火点等方面进行的.
故填:可燃物是否与氧气接触,可燃物是否达到燃烧所需的温度.
(3)①氧气约占空气总体积的五分之一,红磷把氧气耗尽并冷却后,打开止水夹,可以观察到集气瓶中吸入水的体积约占集气瓶体积的五分之一.
故填:1/5.
②碳燃烧生成二氧化碳,二氧化碳是气体,消耗的氧气的体积正好被二氧化碳替代,瓶内压强几乎不变,水不能进入集气瓶.
故填:碳燃烧生成物是二氧化碳气体,瓶内气压不变.
③氢氧化钠溶液能够吸收二氧化碳,但是当瓶内的氧气越来越少时,碳发生不完全燃烧,生成一氧化碳,一氧化碳不溶于氢氧化钠溶液,所以不能得到与甲同学相同的实验结果.
故填:不能,因为碳在氧气不足时燃烧生成一氧化碳,一氧化碳不溶于氢氧化钠溶液.
(4)①氢氧化钠和二氧化碳反应,能够生成碳酸钠和水,反应的化学方程式为:CO2+2NaOH=Na2CO3+H2O.
故填:CO2+2NaOH=Na2CO3+H2O.
②整个过程中,氢氧化钠和二氧化碳反应生成的碳酸钠,和氢氧化钙反应生成碳酸钙和氢氧化钠,反应后分离,氢氧化钠又回到捕捉室,实现了循环利用;氧化钙和水反应生成氢氧化钙,氢氧化钙和碳酸钠反应生成的碳酸钙,分离后进入高温反应炉,在高温条件下,碳酸钙分解生成二氧化碳和氧化钙,氧化钙又和水反应,实现了循环利用.
故填:NaOH、CaO.
③温度越低、压强越大,气体的溶解度越大,所以CO2在深海中的溶解度比在通常情况下在水中的溶解度大.
故填:深海中压强大、温度低,气体(CO2)在水中的溶解度增大.
故填:磷;钾.
(2)①磷燃烧能够生成五氧化二磷,反应的化学反应方程式为:4P+5O2
| ||
故填:4P+5O2
| ||
②该实验中,主要通过控制可燃物是否与氧气接触,温度是否达到可燃物的着火点等方面进行的.
故填:可燃物是否与氧气接触,可燃物是否达到燃烧所需的温度.
(3)①氧气约占空气总体积的五分之一,红磷把氧气耗尽并冷却后,打开止水夹,可以观察到集气瓶中吸入水的体积约占集气瓶体积的五分之一.
故填:1/5.
②碳燃烧生成二氧化碳,二氧化碳是气体,消耗的氧气的体积正好被二氧化碳替代,瓶内压强几乎不变,水不能进入集气瓶.
故填:碳燃烧生成物是二氧化碳气体,瓶内气压不变.
③氢氧化钠溶液能够吸收二氧化碳,但是当瓶内的氧气越来越少时,碳发生不完全燃烧,生成一氧化碳,一氧化碳不溶于氢氧化钠溶液,所以不能得到与甲同学相同的实验结果.
故填:不能,因为碳在氧气不足时燃烧生成一氧化碳,一氧化碳不溶于氢氧化钠溶液.
(4)①氢氧化钠和二氧化碳反应,能够生成碳酸钠和水,反应的化学方程式为:CO2+2NaOH=Na2CO3+H2O.
故填:CO2+2NaOH=Na2CO3+H2O.
②整个过程中,氢氧化钠和二氧化碳反应生成的碳酸钠,和氢氧化钙反应生成碳酸钙和氢氧化钠,反应后分离,氢氧化钠又回到捕捉室,实现了循环利用;氧化钙和水反应生成氢氧化钙,氢氧化钙和碳酸钠反应生成的碳酸钙,分离后进入高温反应炉,在高温条件下,碳酸钙分解生成二氧化碳和氧化钙,氧化钙又和水反应,实现了循环利用.
故填:NaOH、CaO.
③温度越低、压强越大,气体的溶解度越大,所以CO2在深海中的溶解度比在通常情况下在水中的溶解度大.
故填:深海中压强大、温度低,气体(CO2)在水中的溶解度增大.
点评:本题主要考查燃烧的条件、氧气含量的测定、影响气体溶解度的因素和化学方程式的书写等方面的知识,这些内容是考试中经常出现的题目类型.

练习册系列答案
 华东师大版一课一练系列答案
华东师大版一课一练系列答案
相关题目