题目内容
 小希为了测定人体呼出的气体中CO2的体积分数,设计如下实验:①收集5L呼出的气体样品,②在气体样品中加入过量的NaOH溶液,振荡充分反应.③把反应后的溶液转移到烧杯中,慢慢滴入5%的盐酸,到不产生气泡为止.产生气体的体积与加入盐酸质量的关系如图.( CO2的密度为1.96g/L,结果保留两位小数)
小希为了测定人体呼出的气体中CO2的体积分数,设计如下实验:①收集5L呼出的气体样品,②在气体样品中加入过量的NaOH溶液,振荡充分反应.③把反应后的溶液转移到烧杯中,慢慢滴入5%的盐酸,到不产生气泡为止.产生气体的体积与加入盐酸质量的关系如图.( CO2的密度为1.96g/L,结果保留两位小数)
(1)加入5.0g盐酸前没有气泡产生,原因是______(用化学方程式表示);
(2)加入盐酸产生CO2的总质量是多少?
(3)该气体样品中CO2的体积分数为______,人体吸入的空气中CO2的体积分数______%.对此你的解释是______.
解:(1)由于酸首先和过量的氢氧化钠溶液发生反应,所以加入5g盐酸前没有产生气体.
故答案为:NaOH+HCl═NaCl+H2O
(2)碳酸钠反应的盐酸的质量=(19.6g-5.0g)×5%=0.73g
设生成二氧化碳的质量为x
Na2CO3+2HCl═2NaCl+CO2↑+H2O
73 44
0.73g x
 g
g
答:生成二氧化碳的质量为0.44g
(3)二氧化碳的体积=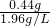 =0.224L
=0.224L
所以二氧化碳的体积分数= ×100%=4.48%
×100%=4.48%
而正常空气中二氧化碳的体积分数为0.03%,这主要是由于人体内含C物质与O2反应生成CO2,使得呼出的气体二氧化碳含量增加.
故答案为:4.48%; 0.03;人体内含C的物质与氧气反应生成CO2.
分析:(1)根据图象可知,稀盐酸先和过量的氢氧化钠溶液反应,再和碳酸钠反应,并能看出和这两种物质反应的稀盐酸的质量;
(2)根据参与反应的稀盐酸中氯化氢的质量,根据反应的化学方程式就可求出生成二氧化碳的质量.
(3)根据二氧化碳的密度和质量可以求出二氧化碳的体积,进而求出体积分数.
点评:本题难度不是很大,主要考查了图象和数据的分析及根据化学方程式进行计算,培养学生的分析能力和解决问题的能力.
故答案为:NaOH+HCl═NaCl+H2O
(2)碳酸钠反应的盐酸的质量=(19.6g-5.0g)×5%=0.73g
设生成二氧化碳的质量为x
Na2CO3+2HCl═2NaCl+CO2↑+H2O
73 44
0.73g x
 g
g答:生成二氧化碳的质量为0.44g
(3)二氧化碳的体积=
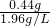 =0.224L
=0.224L所以二氧化碳的体积分数=
 ×100%=4.48%
×100%=4.48% 而正常空气中二氧化碳的体积分数为0.03%,这主要是由于人体内含C物质与O2反应生成CO2,使得呼出的气体二氧化碳含量增加.
故答案为:4.48%; 0.03;人体内含C的物质与氧气反应生成CO2.
分析:(1)根据图象可知,稀盐酸先和过量的氢氧化钠溶液反应,再和碳酸钠反应,并能看出和这两种物质反应的稀盐酸的质量;
(2)根据参与反应的稀盐酸中氯化氢的质量,根据反应的化学方程式就可求出生成二氧化碳的质量.
(3)根据二氧化碳的密度和质量可以求出二氧化碳的体积,进而求出体积分数.
点评:本题难度不是很大,主要考查了图象和数据的分析及根据化学方程式进行计算,培养学生的分析能力和解决问题的能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
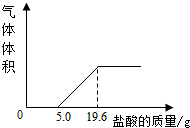 小希为了测定人体呼出的气体中CO2的体积分数,设计如下实验:①收集5L呼出的气体样品,②在气体样品中加入过量的NaOH溶液,振荡充分反应.③把反应后的溶液转移到烧杯中,慢慢滴入5%的盐酸,到不产生气泡为止.产生气体的体积与加入盐酸质量的关系如图.( CO2的密度为1.96g/L,结果保留两位小数)(1)加入5.0g盐酸前没有气泡产生,原因是
小希为了测定人体呼出的气体中CO2的体积分数,设计如下实验:①收集5L呼出的气体样品,②在气体样品中加入过量的NaOH溶液,振荡充分反应.③把反应后的溶液转移到烧杯中,慢慢滴入5%的盐酸,到不产生气泡为止.产生气体的体积与加入盐酸质量的关系如图.( CO2的密度为1.96g/L,结果保留两位小数)(1)加入5.0g盐酸前没有气泡产生,原因是 小希为了测定人体呼出的气体中CO2的体积分数,设计如下实验:①收集5L呼出的气体样品,②在气体样品中加入过量的NaOH溶液,振荡充分反应.③把反应后的溶液转移到烧杯中,慢慢滴入5%的盐酸,到不产生气泡为止.产生气体的体积与加入盐酸质量的关系如图.
小希为了测定人体呼出的气体中CO2的体积分数,设计如下实验:①收集5L呼出的气体样品,②在气体样品中加入过量的NaOH溶液,振荡充分反应.③把反应后的溶液转移到烧杯中,慢慢滴入5%的盐酸,到不产生气泡为止.产生气体的体积与加入盐酸质量的关系如图.
