题目内容
某兴趣小组同学在一次实验中偶然发现:向盛有一定量铁粉的烧杯中加入稀硫酸有气泡产生,迅速加入一定量的氧化铜,搅拌,不再产生气泡、黑色粉末中逐渐出现红色固体后又有气泡产生。请回答:
① 若实验过程中共收集到0.1 g氢气,求生成0.1 g氢气所消耗的硫酸的物质的量。
② 加入氧化铜后,不产生气泡的原因是 (11) (用化学方程式表示)。
③ 充分反应后过滤,为确定滤液中的溶质成分,在滤液样品中插入一根铁丝,可能出现的现象和结论如下。
现象 | 结论 |
(12) | 滤液中的溶质是FeSO4 |
有红色固体析出 | 滤液中的溶质可能有哪几种情况? (13) |
(14) | 滤液中的溶质是 (15) |
① 【解析】
设生成氢气消耗的硫酸的质量为xmol
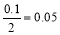 (1分)
(1分)
Fe+H2SO4→FeSO4+H2↑ (1分)
1 1
X 0.05
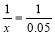 (1分)
(1分)
x=0.05 (1分)
(11)CuO+H2SO4→CuSO4+H2O; (12)无变化;
(13)一定有硫酸亚铁、硫酸铜(1分), 可能有硫酸(1分);
(14)有气泡产生; (15)硫酸、硫酸亚铁
【解析】
试题分析:氢气是由铁和稀硫酸反应生成的,为0.1g,根据氢气的质量来求消耗硫酸的物质的量
【解析】
设生成氢气消耗的硫酸的质量为xmol
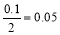
Fe+H2SO4→FeSO4+H2↑
1 1
X 0.05
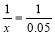
x=0.05
所以消耗硫酸的物质的量为0.05mol,加入氧化铜后,不产生气泡的原因是氧化铜和稀硫酸发生反应:CuO+H2SO4→CuSO4+H2O,铁会先和硫酸铜反应,再和稀硫酸反应,充分反应后过滤,为确定滤液中的溶质成分,在滤液样品中插入一根铁丝,铁丝表面无红色物质产生切不产生气泡,则说明溶质为硫酸亚铁,如果有红色物质产生,说明有硫酸铜,也有还要硫酸亚铁,还可能有硫酸,所以是两种情况,如果有气泡产生说明溶质是硫酸亚铁和硫酸,没有硫酸铜。
考点:溶液成分的分析,根据化学方程式的计算

