题目内容
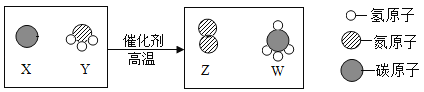
【题目】如图是CO燃烧的的微观示意图。请回答。
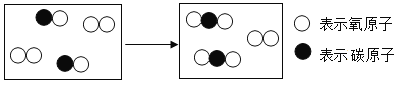
(1)写出该反应的化学方程式_______________________。
(2)结合该变化说明遵循质量守恒定律的原因是在化学反应前后__________________________。
(3)在该反应中参加反应的CO和氧气的质量比为____________。
【答案】2CO+O2![]() 2CO2 原子的种类不变、原子的数目没有增减,原子的质量也没有变化 7:4
2CO2 原子的种类不变、原子的数目没有增减,原子的质量也没有变化 7:4
【解析】
(1)据图可以看出,该反应是一氧化碳和氧气反应生成二氧化碳,反应的化学方程式为:2CO+O2![]() 2CO2;
2CO2;
(2)由反应的微观示意图中微粒的变化可知:该化学变化过程中原子的种类不变、原子的数目没有增减,原子的质量也没有变化,所以该变化质量守恒定律;
(3)由2CO+O2![]() 2CO2可知,参加反应的CO和氧气的质量比=(2
2CO2可知,参加反应的CO和氧气的质量比=(2![]() 28):32=7:4。
28):32=7:4。

【题目】(1)实验室常用氯化铵固体与碱石灰固体共热来制取氨气。常温下NH3是一种无色、有刺激性气味的气体,密度比空气小。NH3极易溶于水,其水溶液呈碱性。

Ⅰ.制取氨气反应的方程式:2NH4Cl+Ca(OH)2=CaCl2+2NH3↑+2X。X的化学式为_____________。
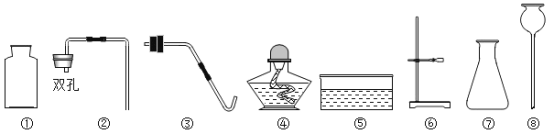
Ⅱ.制取并收集NH3,应该从上图中选择的发生装置是______,收集装置是_______。
Ⅲ.NH3是一种碱性气体,干燥时不能选用下列干燥剂中的______(填序号)。
A.固体氢氧化钠 B.浓硫酸 C.生石灰
(2)刘廷在实验室找到一瓶长期放置的NaOH溶液,欲对其成分进行实验探究。
【收集资料】
Ⅰ.NaOH与CO2分两步反应:2NaOH+CO2=Na2CO3+H2O;
Na2CO3+CO2+H2O= 2NaHCO3
Ⅱ.NaOH与 NaHCO3反应方程式为:NaOH+ NaHCO3=Na2CO3+H2O
Ⅲ.溶液的酸碱性:BaCl2溶液呈中性,其他物质的溶解性见下表
|
|
| |
| 不溶 | 溶 | 溶 |
【提出猜想】刘廷根据资料中的Ⅰ、Ⅱ对其成分提出了以下合理猜想,请将猜想补充完整
猜想1:只有NaOH, 猜想2:只有Na2CO3, 猜想3:只有 NaHCO3
你认为还有可能是______________。
【实验验证】
步骤 | 操作 | 现象 | 结论 |
步骤1 | 取该NaOH溶液,加入过量BaCl | 产生白色沉淀 | p>证明________不成立(填数字) |
步骤2 | 取步骤1中上层清液, 滴加________ | 无气泡产生 | 证明原溶液不含________(填“离子”) |
步骤3 | 另取步骤1中上层清液, 滴加________ | 溶液未变红 | 证明原溶液不含________(填“离子”) |
【实验结论】
通过以上实验操作得出结论:猜想_________是正确的(填数字)。