题目内容
【题目】(7分) 某学生做了如下图所示的实验。
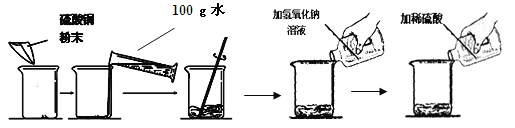
第一次 | 第二次 | |
加入硫酸铜的质量 | m | m |
加入氢氧化钠溶液的质量 | 50g(溶质质量分数16%) | 50g(溶质质量分数16%) |
加入稀硫酸的质量 | 50g | 100g |
实验现象 | 蓝色固体和蓝色溶液 | 蓝色溶液 |
若第二次所加物质恰好完全反应(溶液损失忽略不计),请回答下列问题:
(1)写出实验中发生反应的化学方程式___________________________;
(2)第一次实验后的溶液中所含溶质的化学式为___________________________;
(3)根据已知条件列出求解实验中生成沉淀的质量(x)的比例式______;
(4)实验中加入硫酸铜的质量(m)为______;
(5)在第二次实验中,若向加入氢氧化钠溶液反应后的滤液中加入43.8 g水,则所得溶液中溶质的质量分数为_____________;
(6)若用溶质质量分数为98%的硫酸溶液配制实验中所需的稀硫酸,则需要加水的质量为_________。
【答案】(1)CuSO4+2NaOH=Na2SO4+Cu(OH)2↓ Cu(OH)2+H2SO4= CuSO4+2H2O
(2)CuSO4 Na2SO44 (3)80/98=8g/x
(4)16g (5)7.6% ( 6)135g
【解析】
试题分析:(1) 实验中发生反应的化学方程式,一是氢氧化钠溶液与硫酸铜溶液反应:CuSO4+2NaOH=Na2SO4+Cu(OH)2↓,二是生成的氢氧化铜与硫酸反应:Cu(OH)2+H2SO4= CuSO4+2H2O
(2) 第一次实验后,看到的实验现象蓝色固体和蓝色溶液,所以溶液中所含溶质的化学式为:CuSO4 Na2SO44
(3) 根据化学方程式:CuSO4+2NaOH=Na2SO4+Cu(OH)2↓中氢氧化钠与氢氧化铜的质量关系为80:98,而氢氧化钠的质量=50g×16%=8g,所以实验中生成氢氧化铜沉淀的质量(x)的比例式:80/98=8g/x
(4)同样根据化学方程式:CuSO4+2NaOH=Na2SO4+Cu(OH)2↓中氢氧化钠与硫酸铜的质量关系为80:160,而氢氧化钠的质量=50g×16%=8g, 实验中加入硫酸铜的质量(m)为16g
(5)根据第(4)问,已经计算出溶质硫酸铜的质量为16g,而最终溶液的总质量=16g+50g+100g+43.8g=209.8g,所以所得溶液中溶质的质量分数为=16g/209.8g×100%=7.6%
(6)先计算出稀硫酸的溶质质量分数,根据化学方程式:Cu(OH)2+H2SO4= CuSO4+2H2O中硫酸与硫酸铜的质量关系为80:160,求出溶质硫酸的质量,
解:设溶质硫酸的质量为x
Cu(OH)2+H2SO4= CuSO4+2H2O
160
X 16g
98:160=x:16g
X=9.8g
所以硫酸溶液中溶质的质量分数=9.8g/100g×100%=9.8%
因为两次实验总共消耗硫酸的质量为50g+100g=150g,根据溶液稀释过程中,溶质的质量不变,可设需要加水的质量为y,可列式为:(150g-y)×98%=150×9.8%,所以y=135g

【题目】(6分)蕲春实验中学化学兴趣小组,在学习碱的化学性质时,进行了如图1所示的实验。
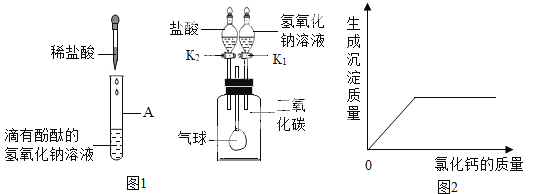
(1)第一组同学在向A中加入一定量的稀盐酸后,发现A中溶液仍然呈红色,则反应后溶液中的溶质是(酚酞除外,用化学式表示) ;第二组同学做完A实验后溶液呈无色,用微观理论解释A中溶液变为无色的反应的实质是 。
(2)第三组同学做B实验用于确认二氧化碳与氢氧化钠能发生化学反应(实验前K1、K2均处于关闭状态)。B实验全过程的操作及现象是:
步骤 | 现象 |
第一步: ; | 气球胀大 |
第二步: 。 | 气球又缩小至原来状态 |
(3)请写出气球缩小至原来状态的化学方程式 。
(4)实验结束后,小军将以上同学做的A、B两个实验的废液均倒入同一个大烧杯中,观察到混合后的废液呈红色,由此产生疑问:
[提出问题]大烧杯的废液中含有哪些溶质?(酚酞除外)
[查阅资料]氯化钙溶液呈中性,CaCl2+Na2CO3=CaCO3↓+2NaCl
[实验验证]取一定量的废液,逐滴加入氯化钙溶液,如图2为同学们根据部分实验现象绘制的关系曲线。
[实验结论]如果观察到的现象只有沉淀产生,溶液仍然为红色,则废液中的溶质为 ;如果观察到有沉淀产生,溶液仍由红色变为无色,则废液中的溶质为 。