题目内容
 右图,是一氧化碳与氧化铁反应的装置图,根据图示回答有关问题:
右图,是一氧化碳与氧化铁反应的装置图,根据图示回答有关问题:
(1)写出一氧化碳与氧化铁反应的化学方程式________;
(2)该实验有以下步骤:①点燃后一个酒精灯 ②点燃前一个酒精灯 ③熄灭前一个酒精灯 ④熄灭后一个酒精灯 ⑤通入纯净的一氧化碳 ⑥停止通入一氧化碳.正确操作步骤的顺序是________.(填序号)
(3)根据此实验写出一氧化碳与二氧化碳化学性质不同之处(写三点)
①________.
②________.
③________.
(4)一氧化碳中混有少量的二氧化碳,除去二氧化碳常用的方法是(用化学方程式表示)
________.
 2Fe+3CO2;
2Fe+3CO2;(2)做一氧化碳还原氧化铁实验时,对于一氧化碳应该是“早出晚归”,前一个酒精灯是“迟到早退”,后一个处理尾气的酒精灯应在通入一氧化碳后立即点燃、最后熄灭,正确的操作顺序是:⑤①②③⑥④;
(3)一氧化碳与二氧化碳化学性质不同之处有很多,如一氧化碳能燃烧而二氧化碳不能,一氧化碳能还原氧化铁而二氧化碳不能,二氧化碳能使石灰石变浑浊而一氧化碳不能等等;
(4)一氧化碳中混有少量的二氧化碳,可通入澄清石灰石除去二氧化碳,反应化学方程式为:Ca(OH)2+CO2═CaCO3↓+H2O;
故答案为:(1)3CO+Fe2O3
 2Fe+3CO2;(2)⑤①②③⑥④;(3)一氧化碳能燃烧,二氧化碳不能燃烧;一氧化碳能和氧化铁反应,二氧化碳不能;二氧化碳能使澄清的石灰水变浑浊,一氧化碳不能;(4)Ca(OH)2+CO2═CaCO3↓+H2O
2Fe+3CO2;(2)⑤①②③⑥④;(3)一氧化碳能燃烧,二氧化碳不能燃烧;一氧化碳能和氧化铁反应,二氧化碳不能;二氧化碳能使澄清的石灰水变浑浊,一氧化碳不能;(4)Ca(OH)2+CO2═CaCO3↓+H2O分析:(1)一氧化碳与氧化铁反应产物为铁和二氧化碳;
(2)做一氧化碳还原氧化铁实验时,应该先通入一氧化碳后点燃酒精灯,这样可以避免一氧化碳和空气混合发生爆炸,反应结束后应先熄灭酒精灯后撤走一氧化碳,这样可以防止高温下的铁又被空气氧化,因为一氧化碳有毒,所以必须要进行尾气处理,可采用点燃的方法;
(3)从题中可以得出一氧化碳和二氧化碳有很多的不同点,从二者的化学性质角度即可作出比较;
(4)从上一小题中二者化学性质的不同即可找出除掉二氧化碳的方法.
点评:本题考查一氧化碳还原氧化铁实验相关操作,设计实验步骤时一定要注意安全原则,即一氧化碳应该是“早出晚归”,前一个酒精灯是“迟到早退”;(4)小题属于实验反思,是在(3)小题的基础上作答,偏难,需要学生熟练掌握课本基础知识,才能顺利作答.

(11分)铁、铝、铜是日常生活中使用最广泛的金属。
(1)上述三种金属中,人类最早大规模冶炼和使用的是铜,最晚的是铝,原因是____
(填序号)。
A.三者在地壳中的含量,铜元素最高,铝元素最低
B.三者的金属活动性,铜元素最弱,铝元素最强
C.在自然界中,铜元素主要以单质形式存在,铝元素以化合物形式存在
(2)常温下一些金属的物理性质数据如下:
|
金属单质 |
铜 |
铝 |
锌 |
铁 |
铅 |
|
导电性(以银的导电性为100作标准) |
99 |
61 |
27 |
17 |
7.9 |
|
密度/(g·cm-3) |
8.92 |
2.70 |
7.14 |
7.86 |
11.3 |
|
熔点/℃ |
1083 |
660 |
419 |
1535 |
328 |
|
硬度(以金刚石的硬度为10作标准) |
2.5~3 |
2~2.9 |
2.5 |
4~5 |
1.5 |
分析上述数据,碎石用的大锤常用铁制而不用铝制,原因是
_________________________________________________________。
(3)金属活动性顺序在运用中给我们三条判断依据,即在金属活动性顺序里:
⑴金属的位置越靠前它的活动性就越强;
⑵位于氢前面的金属能置换出盐酸、稀硫酸中的氢;
⑶位于前面的金属能把位于后面的金属从它们化合物的溶液里置换出来。
通过查阅资料我发现金属铝与氧化铜在高温条件下能发生置换反应,其化学方程式为 ,由此我发现了一条新的判断依据 。
 (4)炼铁的原理是利用一氧化碳与氧
(4)炼铁的原理是利用一氧化碳与氧
化铁反应。在实验室里,可用右图
所示装置进行实验:实验中玻璃管内
的粉末由红色变为 色,该反
应的化学方程式为 ,通过实
验我可以得出的一氧化碳的相关
化学性质是 。
(5)工业上火法炼铜的一个主要反应是 Cu2S
+ O2  2Cu
+ SO2 Cu2S中铜元素的质量分数为_______________
(写出算式)。
2Cu
+ SO2 Cu2S中铜元素的质量分数为_______________
(写出算式)。
用500吨含Cu2S 80%的铜矿石,理论上可以炼出多少吨铜?(请写出详细的计算过程,分步给分,计算结果保留一位小数)

 人类每时每刻都离不开空气,没有空气就没有生命,也就没有生机勃勃的地球.
人类每时每刻都离不开空气,没有空气就没有生命,也就没有生机勃勃的地球.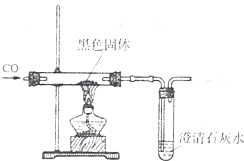 (2008?遵义)碱式碳酸铜[化学式Cu2(OH)2CO3,相对分子质量为222]加热完全分解后生成的黑色固体是什么?甲、乙、丙、丁四位同学对此进行探究.请你与他们一起,踏上探究之路.
(2008?遵义)碱式碳酸铜[化学式Cu2(OH)2CO3,相对分子质量为222]加热完全分解后生成的黑色固体是什么?甲、乙、丙、丁四位同学对此进行探究.请你与他们一起,踏上探究之路. 钢铁的生产和使用时人类文明和社会进步的一个重要标志.从2002起,我国的钢铁产量连续多年保持世界第一.如图的设备可用于工业炼铁.
钢铁的生产和使用时人类文明和社会进步的一个重要标志.从2002起,我国的钢铁产量连续多年保持世界第一.如图的设备可用于工业炼铁.