题目内容
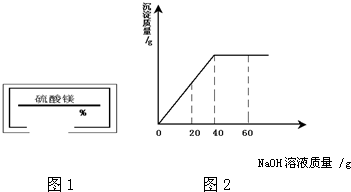 某同学在实验室发现一瓶标签残缺(如图1所示)的溶液.为了测定此溶液的溶质质量分数,他取出50g该溶液,向其中逐滴加入溶质质量分数为10%的NaOH溶液.反应过程中生成沉淀的质量与所用NaOH溶液质量的关系如图2所示.
某同学在实验室发现一瓶标签残缺(如图1所示)的溶液.为了测定此溶液的溶质质量分数,他取出50g该溶液,向其中逐滴加入溶质质量分数为10%的NaOH溶液.反应过程中生成沉淀的质量与所用NaOH溶液质量的关系如图2所示.(1)已知反应的化学方程式为:MgSO4+2NaOH=Mg(OH)2↓+Na2SO4,该反应的类型是
复分解反应
复分解反应
反应;(2)请计算此硫酸镁溶液中溶质的质量分数.
分析:根据复分解反应的定义考虑,根据图表知道消耗氢氧化钠溶液质量为40g,根据氢氧化钠质量算出硫酸镁质量,再除以硫酸镁溶液质量乘以百分之百.
解答:解:MgSO4和NaOH都是化合物,Mg(OH)2和Na2SO4也都是化合物,且是两种化合物相互交换成分生成的两种化合物,所以为复分解反应;
根据图表知道消耗氢氧化钠溶液质量为40g,含有纯氢氧化钠的质量为:40g×10%=4g,设与4g氢氧化钠反应消耗硫酸镁质量为X则:
MgSO4+2NaOH=Mg(OH)2↓+Na2SO4
120 80
X 4g
根据:
=
解得X=6g,硫酸镁溶液中溶质的质量分数
×100%=12%.
故答案为:复分解 12%
根据图表知道消耗氢氧化钠溶液质量为40g,含有纯氢氧化钠的质量为:40g×10%=4g,设与4g氢氧化钠反应消耗硫酸镁质量为X则:
MgSO4+2NaOH=Mg(OH)2↓+Na2SO4
120 80
X 4g
根据:
| 120 |
| 80 |
| X |
| 4g |
| 6g |
| 50g |
故答案为:复分解 12%
点评:解答本题关键是根据图表看出消耗氢氧化钠的质量,根据氢氧化钠的质量算出硫酸镁的质量,再进一步计算硫酸镁的质量分数.

练习册系列答案
 全优点练单元计划系列答案
全优点练单元计划系列答案
相关题目
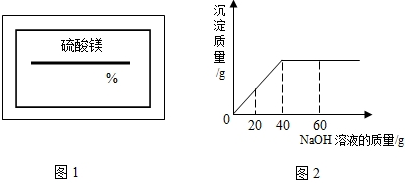
 某同学在实验室发现一瓶标签残缺(如下图所示)的溶液.为了测定此溶液的溶质质量分数,他取出100g该溶液,向其中逐渐滴加溶质质量分数为10%的稀盐酸.放出气体的总质量与所滴入稀盐酸的质量关系曲线如图所示.
某同学在实验室发现一瓶标签残缺(如下图所示)的溶液.为了测定此溶液的溶质质量分数,他取出100g该溶液,向其中逐渐滴加溶质质量分数为10%的稀盐酸.放出气体的总质量与所滴入稀盐酸的质量关系曲线如图所示.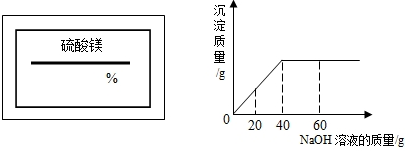
 (2009?南开区一模)某同学在实验室发现一瓶标签残缺的硫酸镁溶液.为了测定此溶液的溶质质量分数,他取出25g该溶液,向其中逐滴加入溶质质量分数为10%的NaOH溶液.反应过程中生成沉淀的质量与所用NaOH溶液质量的关系如图所示.试求:
(2009?南开区一模)某同学在实验室发现一瓶标签残缺的硫酸镁溶液.为了测定此溶液的溶质质量分数,他取出25g该溶液,向其中逐滴加入溶质质量分数为10%的NaOH溶液.反应过程中生成沉淀的质量与所用NaOH溶液质量的关系如图所示.试求: (2008?金城江区)某同学在实验室发现一瓶标签残缺(如图所示)的溶液.为了测定此溶液的溶质质量分数,他取出20g该溶液,向其中逐滴加入溶质质量分数为15%的MgSO4溶液,反应过程中生成沉淀的质量与所用MgSO4溶液质量的关系如图所示.请计算此溶液的溶质质量分数.
(2008?金城江区)某同学在实验室发现一瓶标签残缺(如图所示)的溶液.为了测定此溶液的溶质质量分数,他取出20g该溶液,向其中逐滴加入溶质质量分数为15%的MgSO4溶液,反应过程中生成沉淀的质量与所用MgSO4溶液质量的关系如图所示.请计算此溶液的溶质质量分数.