题目内容
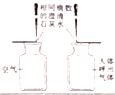
【题目】用如图所示的玻璃管进行碳还原氧化铜实验.
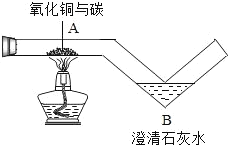
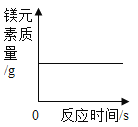
(1)当观察到 B 处的现象是澄清石灰水变浑浊时,则 A 处的现象是________.
(2)查阅资料发现:反应生成的红色固体除了铜以外还可能有氧化亚铜(Cu2O), 则生成氧化亚铜的化学方程式为________.
【答案】黑色粉末变成红色物质 C+4CuO![]() 2Cu2O+CO2↑
2Cu2O+CO2↑
【解析】
氧化铜和碳高温生成铜和二氧化碳,碳与氧化铜加热反应能生成氧化亚铜(Cu2O)和二氧化碳。
(1)碳具有还原性,由图示可知,当观察到 B 处的现象是澄清石灰水变浑浊时,说明了在碳还原氧化铜生成了铜和二氧化碳,则A处的现象是:黑色粉末变成红色物质。
(2)在加热时,碳与氧化铜反应能生成氧化亚铜(Cu2O)和二氧化碳,故反应的化学方程式为C+4CuO![]() 2Cu2O+CO2↑。
2Cu2O+CO2↑。

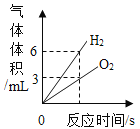
【题目】小明进行H2O2溶液制O2的实验探究。结合下列过程,回答有关问题。
(1)MnO2作催化剂
向5mL5%的H2O2溶液中加入少量MnO2,立即产生大量气泡。
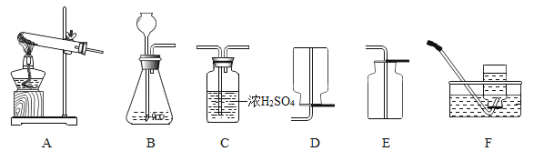
①写出用H2O2溶液制备O2的化学方程式:___________。
②用上述反应原理制备并收集一瓶干燥的O2,从所给装置图中选择并组装一套装置,其连接顺序为___→___→___(填序号)。为了确保实验成功,在装药品之前应该__。
③检验O2的方法是____。若木条复燃,则证明收集的气体为O2。
(2)FeCl3溶液作催化剂
向5mL59%的H2O2溶液中加入2滴定浓度的FeCl3溶液,立即产生大量气泡。
[已知]FeCl3溶液中主要含有三种微粒: H2O、Fe3+、CI-
[问题]哪种微粒对H2O2溶液的分解起催化作用?
[假设]假设一:可能是H2O
假设二:可能是Fe3+
假设三:可能是CI-
[分析]假设一不可能成立,理由是___。
[实验]
操作 | 现象 |
其他条件不变,向H2O2溶液中加入NaCl溶液 | 无明显变化 |
其他条件不变,向H2O2溶液中加入Na2SO4溶液 | 无明显变化 |
其他条件不变,向H2O2溶液中加入Fe2(SO4)3溶液 | 立即产生大量气泡 |
[结论]假设___________成立,而假设一和另一种假设不成立。
(3)催化剂比较
从循环利用的角度分析,______________(填化学式)更适合作该反应的催化剂。
(4)从第(1)题所给装置图中选择并组装一套装置用于实验室制备二氧化碳,反应装置是_________,收集装置是___________,其反应的化学方程式___________。