题目内容
【题目】下面是某兴趣小组同学对暴露在空气的氢氧化钠固体的探究。请回答下列问题:
(1)甲同学取少量固体于试管中用足量的水溶解,后加入过量的CaCl2溶液,观察到________________,证明氢氧化钠固体已经含有Na2CO3。
(2)乙同学对该氢氧化钠固体进行提纯,设计如下操作流程。
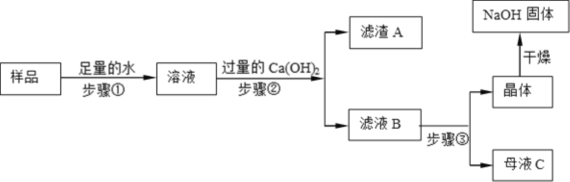
(Ⅰ)步骤②反应的化学方程式是____________,步骤①和②都用到玻璃棒,但作用不同,玻璃棒在步骤①的作用是__________。
(Ⅱ)滤液B中的溶质含有Ca(OH)2,证明Ca(OH)2存在的操作是_________________。
(Ⅲ)步骤③所包含的具体操作是______________、降温结晶、过滤。
(Ⅳ)丙同学认为乙同学流程中的Ca(OH)2可以用稀HCl代替,便于判断反应是否完全,乙同学坚决反对,乙同学反对的理由是_____________________。
【答案】产生白色沉淀 Ca(OH)2+Na2CO3=CaCO3↓+2NaOH 搅拌,加速溶解 通入二氧化碳 加热浓缩 稀盐酸与氢氧化钠、碳酸钠都反应
【解析】
(1)氯化钙与碳酸钠反应生成氯化钠和碳酸钙沉淀。甲同学取少量固体于试管中用足量的水溶解,后加入过量的CaCl2溶液,观察到产生白色沉淀,证明氢氧化钠固体已经含有Na2CO3;
(Ⅰ)碳酸钠和氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,化学方程式为:Ca(OH)2+Na2CO3=CaCO3↓+2NaOH,步骤①是溶解过程,玻璃棒在溶解过程中的作用是:搅拌,加速溶解;
(Ⅱ)二氧化碳能与氢氧化钙反应生成水和碳酸钙沉淀。滤液B中的溶质含有Ca(OH)2,通入二氧化碳,如果变浑浊,则证明Ca(OH)2存在。
(Ⅲ)步骤③所包含的具体操作是加热浓缩、降温结晶、过滤。
(Ⅳ)丙同学认为乙同学流程中的Ca(OH)2可以用稀HCl代替,便于判断反应是否完全,乙同学坚决反对,乙同学反对的理由是稀盐酸与氢氧化钠、碳酸钠都反应。