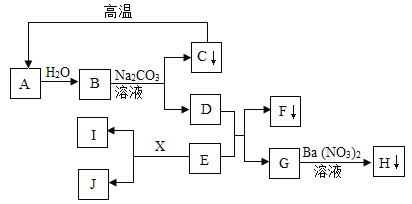
题目内容
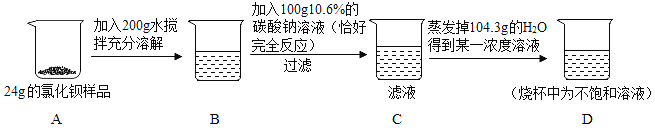
【题目】某粗盐提纯后得到的“精盐”中还含有少量可溶性杂质CaCl2、MgCl2。小青同学设计了以下实验方案来除去可溶性杂质。
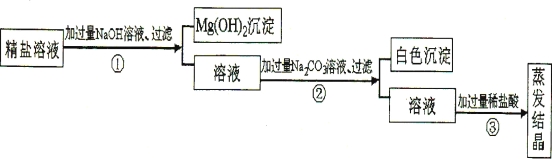
(1)步骤①的化学方程式为 。
(2)步骤②中得到的白色沉淀是 (填化学式)。
(3)步骤③中加稀盐酸是为了除去溶液中的 。
A.CaCl2 B.MgCl2 C.NaOH D.Na2C03
【答案】(1)2NaOH+MgCl2== 2NaCl+Mg(OH)2↓
(2) CaCO3
(3) C、D
【解析】
试题分析:(1)在步骤①加入的氢氧化钠能与粗盐中的氯化镁反应,生成了氢氧化镁沉淀和氯化钠,反应的方程式是:MgCl2+2NaOH=2NaCl+Mg(OH)2↓;
(2)步骤②中加入的碳酸钠能与氯化钙反应生成了CaCO3沉淀和氯化钠;
(3)由于溶液中存在过量的氢氧化钠、碳酸钠.所以,骤③中加稀盐酸是为了除去溶液中的过量的碳酸钠和氢氧化钠。

【题目】某同学对CaH2的制备和性质进行探究。
【阅读资料】①用H2与钙加热制得CaH2 ②钙遇水立即发生剧烈反应生成一种碱和一种气体 ③CaH2要密封保存,遇水反应也生成一种碱和一种气体
【CaH2的制备】设计的制取装置如图所示.
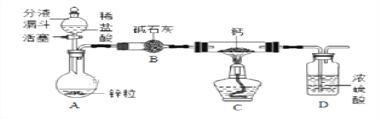
(1)装置B的作用是____________________________;
(2)制备CaH2实验结束后,取少量产物,小心加入水中,观察有气泡产生,在溶液中滴入石蕊试液后显__________色。该同学据此判断:实验中确有氢化钙生成,其他同学提出结论不一定正确,原因是________________________。
【CaH2的性质探究】取少量上述制得的CaH2 样品加入到足量的碳酸钠溶液中,产生大量气泡,过滤,得到滤渣和滤液。经检验滤渣的成分是碳酸钙。该同学进行了如下的探究。
(3)点燃产生的气体,火焰淡蓝色;将燃烧产物通入澄清石灰水中,无现象。则该气体为_________(写化学式)。
(4)对滤液中溶质的成分做出如下猜测并进行实验:
猜想一:NaOH猜想二:NaOH、Ca(OH)2 猜想三:NaOH、Na2CO3 猜想四:NaOH、Na2CO3、Ca(OH)2
经过讨论,大家一致认为猜想四不合理,请用化学方程式说明原因___________________
【实验验证】
实验 | 现象 | 结论 |
实验一:取滤液,向其中滴入少量 Na2CO3溶液 | ____________ | 猜想二不成立 |
实验二:另取滤液,向其中加入足量稀盐酸 | ________________ | 猜想三成立 |
【定量分析】
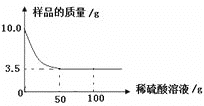
取制得的CaH2样品1g(杂质为未反应完的Ca)加入到足量的Na2CO3溶液中,充分反应后,过滤、洗涤、干燥称得CaCO3质量为2.4g,则该样品中CaH2的质量分数为__________(写出计算过程).
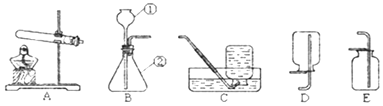
【题目】小峰和小刚阅读试剂标签后发现,市场销售的高锰酸钾晶体纯度高达99.5%,含水量可以忽略不计。为探究“试管放置方式对高锰酸钾制取氧气速度和体积的影响”,他俩设计了制取氧气的直立型装置(如图),并与斜卧型装置比较,在气密性良好的装置中分别加入5.0克高锰酸钾晶体,用同一酒精灯分别加热,用同一型号的集气瓶收集气体,每组实验进行五次,实验数据取平均值后记录如下表:
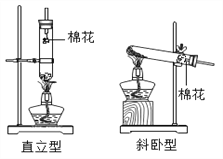
装置类型 | 直立型 | 斜卧型 |
收集1瓶氧气所需时间/秒 | 59 | 68 |
收集2瓶氧气所需时间/秒 | 95 | 108 |
收集氧气的总体积/毫升 | 525 | 476 |
(1)写出高锰酸钾受热分解的化学方程式 ____________________;
(2)收集2瓶氧气,所需时间较短的装置类型是 ____________________;
(3)等质量的高锰酸钾加热到不再产生气体,斜卧型装置收集到氧气的总体积比直立型少的原因是 ____________________ ;
(4)根据高锰酸钾分解的化学方程式,算出5.0克高锰酸钾生成的氧气体积为理论值。实验中发现,斜卧型发生装置收集到的氧气体积明显大于理论值,他们对其原因进行了探究:
【提出假设】
小峰假设:反应生成的二氧化锰在较高温度下受热分解放出氧气;
你的假设:_________________________。
【设计实验】要验证小峰的假设能否成立,请设计简明的实验方案 _______________ 。
【题目】下列依据实验目的所设计的实验过程,不合理的是![]()
选项 | 实验目的 | 实验设计 |
A | 鉴别硝酸钾溶液和碳酸钾溶液 | 取样滴加稀盐酸,观察是否产生气泡 |
B | 鉴别合成纤维和羊毛纤维 | 取样品灼烧 |
C | 除去一氧化碳中少量二氧化碳气体 | 将气体通过灼热的氧化铜粉末 |
D | 除去氯化钠固体中混有的泥沙 | 溶解、过滤、蒸发 |
A. A B. B C. C D. D