题目内容
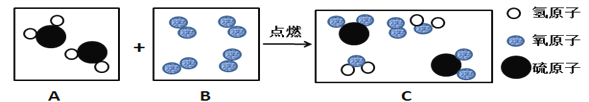
【题目】为了发展低碳经济,有科学家提出一种“绿色自由”构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,经过化学反应后转变为甲醇(CH3OH) “绿色自由”构想技术简要流程如图所示.
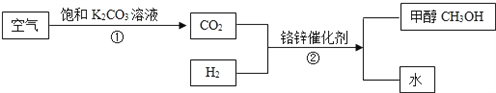
(1)写出流程中一种氧化物的名称________________
(2)大气中CO2过多会引起 ____________效应.
(3)写出步骤②的化学反应方程式__________
(4)步骤②中铬锌催化剂在反应前后 ______和__________不变.
(5)甲醇和乙醇同属醇类,请推测甲醇的一个化学性质 ____________.
【答案】 二氧化碳 温室效应 CO2+3H2![]() CH3OH+H2O 质量 化学性质 可燃性
CH3OH+H2O 质量 化学性质 可燃性
【解析】(1)氧化物是由两种元素组成,其中一种元素是氧元素的化合物,通过分析流程中的物质,二氧化碳和水都满足氧化物的定义,所以流程中氧化物的名称可以是:二氧化碳;
(2)大气中的二氧化碳含量增加,会使地球表面的温度升高,加剧温室效应;
(3)二氧化碳和氢气在铬锌催化剂的催化作用下生成甲醇和水,化学方程式为:CO2+3H2 ![]() CH3OH+H2O;
CH3OH+H2O;
(4)在化学变化中可以改变化学反应速率,而本身的质量和化学性质在化学反应前后都保持不变的物质叫催化剂,所以步骤②中铬锌催化剂在反应前后质量和和化学性质不变;
(5)乙醇在实验室通过燃烧可以为一些化学反应提供热量,在日常生活中也可以通过燃烧提供能量,所以乙醇具有可燃性,通过类比思想可知,甲醇也具有可燃性。

 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案【题目】某研究性学习小组对炭粉与氧化铜反应产物中气体的成分进行研究。
【提出假设】该反应的气体产物中有二氧化碳和其他气体。
【查阅资料】氮气不能跟炭粉和氧化铜发生反应,也不跟石灰水反应,可用来隔绝氧气。
【设计方案】将一定量氧化铜在隔绝氧气的条件下与过量炭粉充分反应。通过测定反应前后相关物质的质量进行判断。
【进行实验】

操作步骤 | 实验现象及分析 |
取1.6 g氧化铜与1 g炭粉均匀混合,放入质量为48.2 g的B装置的玻璃管中。 | |
打开弹簧夹,往贮气瓶A中注入水,将氮气通入B装置中。 | ①水应从_______端注入(填“a”或“b”)。 |
先通一段时间氮气。 | ②目的是_____________。 |
夹紧弹簧夹,用酒精喷灯加热玻璃管内的混合物。 | ③玻璃管中的现象是______________。 |
停止加热,再通入一段时间氮气。 | ④目的是________________。 |
实验完毕后,冷却装置至室温,称得B玻璃管及固体总质量为50.2 g,称得C瓶中液体增重0.4 g。 | ⑤结论:原假设_____(填“成立”或“不成立”),理由是____________(用计算式表示)。 |