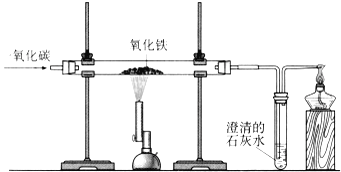
��Ŀ����
����Ŀ��Ϊ�ⶨһ��ǩ������ͼ���ĸ�Ƭ��̼��Ƶĺ�����ijͬѧ����ͼʵ�飺ȡ10Ƭ��Ƭ���������ྻ���ձ��У�Ȼ����εμ�ϡ���ᣬ������50g�����ǡ����ȫ��Ӧ����ʱ�����ձ���ʣ�����ʵ�������Ϊ65.6g����Ƭ�������ɷֲ���ϡ���ᷴӦ����Ӧ�в���������ȫ���ų�����

��1����Ӧ������_________g������̼���ø�Ƭ��̼��Ƶ���������Ϊ_________��
��2���Լ�������ϡ������HCl������������
���𰸡���1��4.4��50%����2��14.6%��
��������
�����������1����Ϊ̼��ƺ�ϡ���ᷴӦ�ų�������̼�����������غ㶨�ɿ�֪���ձ��е����ʼ��ٵ������������ɵĶ�����̼���������������ɶ�����̼������Ϊ��2g��10+50g��65.6g=4.4g��
��2����10ƬƬ����̼��Ƶ�����Ϊx�����������е��Ȼ�������Ϊy��
CaCO3+2HCl�TCaCl2+H2O+CO2��
100 73 44
x y 4.4g
100:x=73��y=44:4.4g�����x=10g��y=7.3g����̼��Ƶ�����������(10g��20g) ��100�� =50%��
��2������ϡ�������������������(7.3g��50g)��100��=14.6%��

����Ŀ��ijУ��ȤС����ʵ��������ȡ������ʵ�飬����ȡ����غͶ������̵Ļ����6.0g������Թ��н��м��ȣ����ڲ�ͬʱ�̲ⶨ�Թ���ʣ�������������±�
��Ӧʱ��/min | 1.0 | 1.5 | 2.0 | 2.5 | 3.0 | 3.5 |
ʣ���������/g | 5.1 | 4.5 | 4.2 | 4.08 | 4.08 | 4.08 |
�����������ݣ�����������⣺
��1��������мء��ȡ�������Ԫ�ص�������Ϊ ������������ȣ�
��2����������������Ϊ g��
��3��ԭ������ж������̵����������Ƕ��٣���д��������̣���������ȷ��0.1%��