题目内容
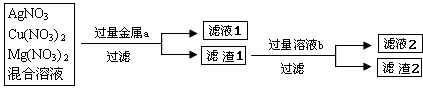
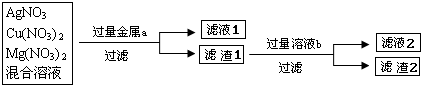
化学实验室现有一瓶废液,它是硝酸银、硝酸铜和硝酸镁三种物质组成的混合溶液,实验员老师欲对此废液进行处理回收金属铜和银,实验方案如下图所示:
张老师知道后,拿到课堂请同学们结合所学到的“常见金属活动性顺序表”对此实验方案进行分析,请你认真阅读以上实验流程,回答以下问题:
(1)把以下残缺的“常见金属活动性顺序表”填写完整

(2)你选用的金属a是______,滤液1中的溶质是______.若要使滤液1中的溶质只有一种,选用的金属a只能是______.
(3)你选用的溶液b是______,其作用是______滤液2中的溶质是______(写化学式)
(4)滤渣2的成分是Cu 和 Ag,为进一步提纯Ag,请设计实验把滤渣2的Cu出去______(用化学方程式表示)

张老师知道后,拿到课堂请同学们结合所学到的“常见金属活动性顺序表”对此实验方案进行分析,请你认真阅读以上实验流程,回答以下问题:
(1)把以下残缺的“常见金属活动性顺序表”填写完整

(2)你选用的金属a是______,滤液1中的溶质是______.若要使滤液1中的溶质只有一种,选用的金属a只能是______.
(3)你选用的溶液b是______,其作用是______滤液2中的溶质是______(写化学式)
(4)滤渣2的成分是Cu 和 Ag,为进一步提纯Ag,请设计实验把滤渣2的Cu出去______(用化学方程式表示)
(1)常见金属活动性顺序表为:K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au;
(2)由于镁、铜、银的金属活动性强弱为镁>铜>银,为回收金属铜和银,选用的金属a应该排在铜、银的前面,可选锌.如果选锌,则锌和硝酸银反应生成银和硝酸锌,锌和硝酸铜反应生成铜和硝酸锌,而锌不和硝酸镁反应,所以滤液1中的溶质是硝酸锌和硝酸镁.要使滤液1中的溶质只有一种,可选金属镁,镁和硝酸银反应生成银和硝酸镁,镁和硝酸铜反应生成铜和硝酸镁;
(3)滤渣1中含有铜、银、镁,为回收金属铜和银除去镁,可选稀硫酸,镁和硫酸反应生成硫酸镁和氢气,滤液2中的溶质是硫酸镁,化学式为:MgSO4;
(4)由于铜、银的金属活动性强弱为铜>银,除去Cu、Ag混合物中的铜,可选硝酸银溶液,铜和硝酸银反应生成银和硝酸铜,反应的化学方程式为:Cu+2AgNO3=Cu(NO3)2+2Ag.
故答案为:(1)K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au;
(2)锌;硝酸锌、硝酸镁;镁;
(3)稀硫酸;除去金属镁;MgSO4;
(4)Cu+2AgNO3=Cu(NO3)2+2Ag.
(2)由于镁、铜、银的金属活动性强弱为镁>铜>银,为回收金属铜和银,选用的金属a应该排在铜、银的前面,可选锌.如果选锌,则锌和硝酸银反应生成银和硝酸锌,锌和硝酸铜反应生成铜和硝酸锌,而锌不和硝酸镁反应,所以滤液1中的溶质是硝酸锌和硝酸镁.要使滤液1中的溶质只有一种,可选金属镁,镁和硝酸银反应生成银和硝酸镁,镁和硝酸铜反应生成铜和硝酸镁;
(3)滤渣1中含有铜、银、镁,为回收金属铜和银除去镁,可选稀硫酸,镁和硫酸反应生成硫酸镁和氢气,滤液2中的溶质是硫酸镁,化学式为:MgSO4;
(4)由于铜、银的金属活动性强弱为铜>银,除去Cu、Ag混合物中的铜,可选硝酸银溶液,铜和硝酸银反应生成银和硝酸铜,反应的化学方程式为:Cu+2AgNO3=Cu(NO3)2+2Ag.
故答案为:(1)K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au;
(2)锌;硝酸锌、硝酸镁;镁;
(3)稀硫酸;除去金属镁;MgSO4;
(4)Cu+2AgNO3=Cu(NO3)2+2Ag.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目