题目内容
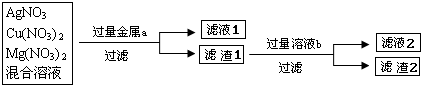
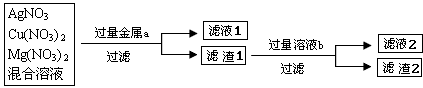
化学实验室现有一瓶废液,它是硝酸银、硝酸铜和硝酸镁三种物质组成的混合溶液,实验员老师欲对此废液进行处理回收金属铜和银,实验方案如下图所示:
张老师知道后,拿到课堂请同学们结合所学到的“常见金属活动性顺序表”对此实验方案进行分析,请你认真阅读以上实验流程,回答以下问题:
(1)把以下残缺的“常见金属活动性顺序表”填写完整

(2)你选用的金属a是 ,滤液1中的溶质是 .若要使滤液1中的溶质只有一种,选用的金属a只能是 .
(3)你选用的溶液b是 ,其作用是 滤液2中的溶质是 (写化学式)
(4)滤渣2的成分是Cu 和 Ag,为进一步提纯Ag,请设计实验把滤渣2的Cu出去 (用化学方程式表示)
【答案】分析:(1)根据金属的活动顺序表进行解答;
(2)根据镁、铜、银的活动顺序进行解答;
(3)根据排在氢前面的金属可以和酸(稀盐酸或稀硫酸)反应放出氢气进行解答;
(4)利用铜、银的活动顺序来选取盐溶液.
解答:解:(1)常见金属活动性顺序表为:K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au;
(2)由于镁、铜、银的金属活动性强弱为镁>铜>银,为回收金属铜和银,选用的金属a应该排在铜、银的前面,可选锌.如果选锌,则锌和硝酸银反应生成银和硝酸锌,锌和硝酸铜反应生成铜和硝酸锌,而锌不和硝酸镁反应,所以滤液1中的溶质是硝酸锌和硝酸镁.要使滤液1中的溶质只有一种,可选金属镁,镁和硝酸银反应生成银和硝酸镁,镁和硝酸铜反应生成铜和硝酸镁;
(3)滤渣1中含有铜、银、镁,为回收金属铜和银除去镁,可选稀硫酸,镁和硫酸反应生成硫酸镁和氢气,滤液2中的溶质是硫酸镁,化学式为:MgSO4;
(4)由于铜、银的金属活动性强弱为铜>银,除去Cu、Ag混合物中的铜,可选硝酸银溶液,铜和硝酸银反应生成银和硝酸铜,反应的化学方程式为:Cu+2AgNO3=Cu(NO3)2+2Ag.
故答案为:(1)K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au;
(2)锌;硝酸锌、硝酸镁;镁;
(3)稀硫酸;除去金属镁;MgSO4;
(4)Cu+2AgNO3=Cu(NO3)2+2Ag.
点评:此题主要考查金属的活动顺序以及根据金属的活动顺序设计实验方案,难度较大,做题时需要同学们要根据金属的性质及活动性强弱认真思考.
(2)根据镁、铜、银的活动顺序进行解答;
(3)根据排在氢前面的金属可以和酸(稀盐酸或稀硫酸)反应放出氢气进行解答;
(4)利用铜、银的活动顺序来选取盐溶液.
解答:解:(1)常见金属活动性顺序表为:K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au;
(2)由于镁、铜、银的金属活动性强弱为镁>铜>银,为回收金属铜和银,选用的金属a应该排在铜、银的前面,可选锌.如果选锌,则锌和硝酸银反应生成银和硝酸锌,锌和硝酸铜反应生成铜和硝酸锌,而锌不和硝酸镁反应,所以滤液1中的溶质是硝酸锌和硝酸镁.要使滤液1中的溶质只有一种,可选金属镁,镁和硝酸银反应生成银和硝酸镁,镁和硝酸铜反应生成铜和硝酸镁;
(3)滤渣1中含有铜、银、镁,为回收金属铜和银除去镁,可选稀硫酸,镁和硫酸反应生成硫酸镁和氢气,滤液2中的溶质是硫酸镁,化学式为:MgSO4;
(4)由于铜、银的金属活动性强弱为铜>银,除去Cu、Ag混合物中的铜,可选硝酸银溶液,铜和硝酸银反应生成银和硝酸铜,反应的化学方程式为:Cu+2AgNO3=Cu(NO3)2+2Ag.
故答案为:(1)K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au;
(2)锌;硝酸锌、硝酸镁;镁;
(3)稀硫酸;除去金属镁;MgSO4;
(4)Cu+2AgNO3=Cu(NO3)2+2Ag.
点评:此题主要考查金属的活动顺序以及根据金属的活动顺序设计实验方案,难度较大,做题时需要同学们要根据金属的性质及活动性强弱认真思考.

练习册系列答案
 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案
相关题目