题目内容
【题目】已知:碳酸钠(Na2CO3)固体受热不易分解,碳酸氢钠(NaHCO3)固体受热易分解:2NaHCO3![]() Na2CO3+CO2↑+H2O.某碳酸钠样品中混有少量的碳酸氢钠,为了测定该碳酸钠样品中Na2CO3的质量分数,某同学做了如下实验:准确称取10.0g该碳酸钠样品放入试管中,加热充分反应至无气体放出,共产生CO2气体224mL(该条件下气体的密度为1.964g/L)。请回答下列问题:
Na2CO3+CO2↑+H2O.某碳酸钠样品中混有少量的碳酸氢钠,为了测定该碳酸钠样品中Na2CO3的质量分数,某同学做了如下实验:准确称取10.0g该碳酸钠样品放入试管中,加热充分反应至无气体放出,共产生CO2气体224mL(该条件下气体的密度为1.964g/L)。请回答下列问题:
(1)生成CO2的质量为____________g(计算结果精确到0.01g)。
(2)该碳酸钠样品中Na2CO3的质量分数是多少?(写出计算过程,计算结果精确到0.1%)
(3)10.0g该碳酸钠样品充分加热至无气体放出,冷却后所得干燥固体的质量为 g。
【答案】(1)0.44 (2)83.2% (3)9.38g
【解析】
试题分析:(1)生成的二氧化碳的质量=0.224L×1.964g/L=0.44g ;
(2)利用化学方程式,根据反应的质量比即可计算出他碳酸氢钠的质量。
解设10.0g该碳酸钠样品中含NaHCO3质量为x ,生成的水的质量为y ;
2NaHCO3 ![]() Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
168 44 18
x 0.44g y
168:44 = x:0.44g
x = 1.68g
ω(Na2CO3)=(10.0g-1.68g)÷10.0g×100% = 83.2%
(3)生成的水的质量为:44/18=0.44g/y
Y=0.18g
根据质量守恒定律,10.0g该碳酸钠样品充分加热至无气体放出,
冷却后所得干燥固体的质量=10g-0.44g-0.18g=9.38g 。

 计算高手系列答案
计算高手系列答案【题目】今天又是化学实验室开放日,老师拿出两瓶无标签的试剂,分别是固体和液体,他取少量试剂在试管中混合,立即产生一种无色气体,将此气体用集气瓶收集后,我们对气体展开了一系列探究:
(1)此气体是什么物质?验证它的实验方案如下
猜想 | 实验现象 | 实验结论及解释 |
此气体可能是 |
| 化学方程为:
|
(2)我想用图所示仪器中的几种来制取该气体,(填序号)则发生装置是 ;收集装置是
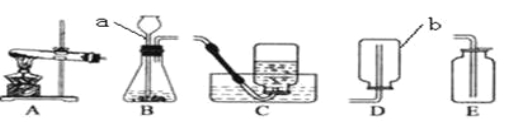
(3)指出仪器名称:a是 b是
(4)如果用右图所示的装置收集该气体,气体由 端(填“A或“B”)导入。
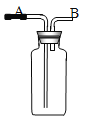
(5)我猜想此无色气体还可能是 气体,可以制取它的化学方程式是若用右图装置盛满水收集氧气,气体由 端(填“A或“B”)导入
(6)甲烷是一种无色、无味、难溶于水的气体,实验室用加热无水醋酸钠和碱石灰的固体混合物的方法制取甲烷,则实验室制取并收集甲烷应选择的装置组合是
