题目内容
(2010?天河区模拟)下面是甲、乙、丙、丁四种常见金属与盐酸反应的比较示意图.以下说法错误的是( )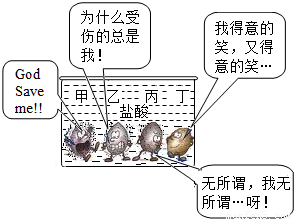
【答案】分析:根据图片中四种金属表面气泡及量的多少,判断金属与酸反应的剧烈程度,由此判断金属的活动性;结合金属活动性顺序表,猜测金属的可能性.
解答:解:A、图片中金属甲、乙、丙表面出现气泡,说明三种金属能与酸反应;金属丁表面无气泡,说明金属丁不能与酸反应;该选项判断正确;
B、金属甲、乙、丙表面的气泡为三种金属与盐酸反应生成的氢气,该反应为置换反应;该选项判断正确;
C、金属丙表面气泡比金属乙少,说明金属丙与盐酸反应不如金属乙剧烈,则金属丙的活动性比乙弱;根据金属活动性:锌大于铁,所以,若乙为金属锌,丙可能为金属铁,但由于金属铜不能与盐酸反应,因此金属丙为铜的判断是不正确的;
D、图中金属甲表面气泡最多,其次为金属乙,最少的为金属丙,金属丁表面无气泡,所以四种金属活动性由强到弱的顺序为:甲>乙>丙>丁.该选项判断正确;
故选C
点评:金属与酸反应剧烈程度与金属活动性相关,反应越剧烈金属活动性越强.
解答:解:A、图片中金属甲、乙、丙表面出现气泡,说明三种金属能与酸反应;金属丁表面无气泡,说明金属丁不能与酸反应;该选项判断正确;
B、金属甲、乙、丙表面的气泡为三种金属与盐酸反应生成的氢气,该反应为置换反应;该选项判断正确;
C、金属丙表面气泡比金属乙少,说明金属丙与盐酸反应不如金属乙剧烈,则金属丙的活动性比乙弱;根据金属活动性:锌大于铁,所以,若乙为金属锌,丙可能为金属铁,但由于金属铜不能与盐酸反应,因此金属丙为铜的判断是不正确的;
D、图中金属甲表面气泡最多,其次为金属乙,最少的为金属丙,金属丁表面无气泡,所以四种金属活动性由强到弱的顺序为:甲>乙>丙>丁.该选项判断正确;
故选C
点评:金属与酸反应剧烈程度与金属活动性相关,反应越剧烈金属活动性越强.

练习册系列答案
 金钥匙试卷系列答案
金钥匙试卷系列答案
相关题目