题目内容
某兴趣小组探究金属的反应规律.
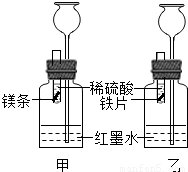
【探究】在室温条件下进行如图所示实验.
(1)实验室稀释浓硫酸时,需要用到的实验仪器有______.
(2)将形状和大小相同、表面均打磨洁净的镁和铁放入试管内,在两试管内同时加入等质量、等质量分数的稀硫酸.若要比较镁和铁的金属活动性,观察到的实验现象是______.
(3)若实验所用的金属均过量,则装置甲中产生的H2的质量______(选填“大于”、“小于”或“等于”)装置乙中产生的H2质量.
【探究】将一定量的镁粉加入到硫酸亚铁和硫酸铜的混合溶液中,充分反应后过滤,将滤出的固体放入少量稀硫酸中,没有气泡产生.那么,滤出的固体和滤液中分别一定含有______.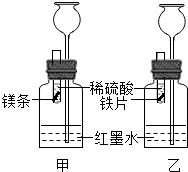
【探究】在室温条件下进行如图所示实验.
(1)实验室稀释浓硫酸时,需要用到的实验仪器有______.
(2)将形状和大小相同、表面均打磨洁净的镁和铁放入试管内,在两试管内同时加入等质量、等质量分数的稀硫酸.若要比较镁和铁的金属活动性,观察到的实验现象是______.
(3)若实验所用的金属均过量,则装置甲中产生的H2的质量______(选填“大于”、“小于”或“等于”)装置乙中产生的H2质量.
【探究】将一定量的镁粉加入到硫酸亚铁和硫酸铜的混合溶液中,充分反应后过滤,将滤出的固体放入少量稀硫酸中,没有气泡产生.那么,滤出的固体和滤液中分别一定含有______.

(1)实验室稀释浓硫酸时,需要用到的实验仪器有玻璃棒、烧杯.
故填:玻璃棒、烧杯.
(2)因为镁比铁活泼,所以分别于等质量、等质量分数的稀硫酸反应时,镁和稀硫酸产生气泡的速率比铁和稀硫酸产生气泡的速率快.
故填:镁和稀硫酸产生气泡的速率比铁和稀硫酸产生气泡的速率快.
(3)若镁和铁均过量,则装置甲中产生的H2的质量等于装置乙中产生的H2质量.
故填:等于.
(4)将滤出的固体放入少量稀硫酸中,没有气泡产生,说明固体中不含有镁和铁,镁完全反应,与硫酸铜反应生成铜和硫酸镁,硫酸铜是否完全反应无法确定,硫酸亚铁没有参加反应,所以滤出的固体中只有铜,滤液中一定含有硫酸镁和硫酸亚铁,是否含有硫酸铜无法确定.
故填:铜、硫酸镁和硫酸亚铁.
故填:玻璃棒、烧杯.
(2)因为镁比铁活泼,所以分别于等质量、等质量分数的稀硫酸反应时,镁和稀硫酸产生气泡的速率比铁和稀硫酸产生气泡的速率快.
故填:镁和稀硫酸产生气泡的速率比铁和稀硫酸产生气泡的速率快.
(3)若镁和铁均过量,则装置甲中产生的H2的质量等于装置乙中产生的H2质量.
故填:等于.
(4)将滤出的固体放入少量稀硫酸中,没有气泡产生,说明固体中不含有镁和铁,镁完全反应,与硫酸铜反应生成铜和硫酸镁,硫酸铜是否完全反应无法确定,硫酸亚铁没有参加反应,所以滤出的固体中只有铜,滤液中一定含有硫酸镁和硫酸亚铁,是否含有硫酸铜无法确定.
故填:铜、硫酸镁和硫酸亚铁.

练习册系列答案
相关题目

 (2013?下城区二模)某兴趣小组探究金属的反应规律.
(2013?下城区二模)某兴趣小组探究金属的反应规律. 某兴趣小组探究金属的反应规律.
某兴趣小组探究金属的反应规律.