题目内容
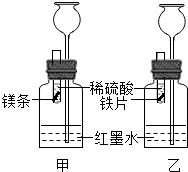
某兴趣小组探究金属的反应规律.【探究】在室温条件下进行如图所示实验.
(1)实验室稀释浓硫酸时,需要用到的实验仪器有 .
(2)将形状和大小相同、表面均打磨洁净的镁和铁放入试管内,在两试管内同时加入等质量、等质量分数的稀硫酸.若要比较镁和铁的金属活动性,观察到的实验现象是 .
(3)若实验所用的金属均过量,则装置甲中产生的H2的质量 (选填“大于”、“小于”或“等于”)装置乙中产生的H2质量.
【探究】将一定量的镁粉加入到硫酸亚铁和硫酸铜的混合溶液中,充分反应后过滤,将滤出的固体放入少量稀硫酸中,没有气泡产生.那么,滤出的固体和滤液中分别一定含有 .
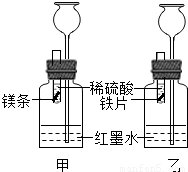
【答案】分析:(1)稀释浓硫酸时,把浓硫酸沿着烧杯内壁缓缓注入水中,并且用玻璃棒不断搅拌;
(2)金属越活泼,与稀盐酸或稀硫酸反应时速率越快,产生的气泡越多;
(3)当金属过量时,与酸反应生成氢气的质量决定于酸的质量;
根据实验现象可以判断物质的组成情况.
解答:解:(1)实验室稀释浓硫酸时,需要用到的实验仪器有玻璃棒、烧杯.
故填:玻璃棒、烧杯.
(2)因为镁比铁活泼,所以分别于等质量、等质量分数的稀硫酸反应时,镁和稀硫酸产生气泡的速率比铁和稀硫酸产生气泡的速率快.
故填:镁和稀硫酸产生气泡的速率比铁和稀硫酸产生气泡的速率快.
(3)若镁和铁均过量,则装置甲中产生的H2的质量等于装置乙中产生的H2质量.
故填:等于.
(4)将滤出的固体放入少量稀硫酸中,没有气泡产生,说明固体中不含有镁和铁,镁完全反应,与硫酸铜反应生成铜和硫酸镁,硫酸铜是否完全反应无法确定,硫酸亚铁没有参加反应,所以滤出的固体中只有铜,滤液中一定含有硫酸镁和硫酸亚铁,是否含有硫酸铜无法确定.
故填:铜、硫酸镁和硫酸亚铁.
点评:化学实验现象是化学实验最突出、最鲜明的部分,也是进行分析推理得出结论的依据,掌握物质的性质和相互之间的反应关系,有助于提高观察实验、进行实验的能力.
(2)金属越活泼,与稀盐酸或稀硫酸反应时速率越快,产生的气泡越多;
(3)当金属过量时,与酸反应生成氢气的质量决定于酸的质量;
根据实验现象可以判断物质的组成情况.
解答:解:(1)实验室稀释浓硫酸时,需要用到的实验仪器有玻璃棒、烧杯.
故填:玻璃棒、烧杯.
(2)因为镁比铁活泼,所以分别于等质量、等质量分数的稀硫酸反应时,镁和稀硫酸产生气泡的速率比铁和稀硫酸产生气泡的速率快.
故填:镁和稀硫酸产生气泡的速率比铁和稀硫酸产生气泡的速率快.
(3)若镁和铁均过量,则装置甲中产生的H2的质量等于装置乙中产生的H2质量.
故填:等于.
(4)将滤出的固体放入少量稀硫酸中,没有气泡产生,说明固体中不含有镁和铁,镁完全反应,与硫酸铜反应生成铜和硫酸镁,硫酸铜是否完全反应无法确定,硫酸亚铁没有参加反应,所以滤出的固体中只有铜,滤液中一定含有硫酸镁和硫酸亚铁,是否含有硫酸铜无法确定.
故填:铜、硫酸镁和硫酸亚铁.
点评:化学实验现象是化学实验最突出、最鲜明的部分,也是进行分析推理得出结论的依据,掌握物质的性质和相互之间的反应关系,有助于提高观察实验、进行实验的能力.

练习册系列答案
相关题目

 (2013?下城区二模)某兴趣小组探究金属的反应规律.
(2013?下城区二模)某兴趣小组探究金属的反应规律. 某兴趣小组探究金属的反应规律.
某兴趣小组探究金属的反应规律.