题目内容
【题目】用元素符号或化学式填空:
(1)3个硫原子____(2)3个亚铁离子__(3)+6价硫元素的氧化物化学式_____
(4)三氧化二铁____ (5)8个水分子____(6)氧化铜中铜元素显+2价___
(7)按要求写出下列数字“2”表达的含义: Mg2+________2CO __________
(8)计算下列物质的相对分子质量; Mr(CuSO4)_____ Mr[Mg(OH)2]_____
【答案】3S 3Fe2+ SO3 Fe2O3 8H2O ![]() 一个镁离子带2个单位正电荷 两个一氧化碳分子 160 58
一个镁离子带2个单位正电荷 两个一氧化碳分子 160 58
【解析】
(1)原子的表示方法是用元素符号来表示一个原子,表示多个该原子,在其元素符号前加上相应的数字,3个硫原子表示为:3S;
(2)离子的表示方法是在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略。表示多个该离子,在其离子符号前加上相应的数字,1个亚铁离子带2个单位的正电荷, 3个亚铁离子可表示为:3Fe2+;
(3)硫元素显+6价,氧元素显-2价,其氧化物的化学式为:SO3;
(4)三氧化二铁中铁元素显+3价,氧元素显-2价,根据化合物中元素的化合价代数和为零,化学式为:Fe2O3;
(5)分子的表示方法是正确书写物质的化学式,表示多个该分子,在其化学式前加上相应的数字,则8个水分子可表示为:8H2O;
(6)化合价的表示方法是在其化学式该元素的上方用正负号和数字表示,正负号在前,数字在后,氧化铜中铜元素显+2价可表示为:![]() ;
;
(7)标在元素符号右上角的数字表示离子所带电荷数。 Mg2+ 中数字“2”的含义为:一个镁离子带2个单位正电荷;标在化学式前面的数字表示分子的数目。2CO表示两个一氧化碳分子;
(8)Mr(CuSO4)=64+32+16×4=160,Mr[Mg(OH)2]=24+(16+1)×2=58。

 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案【题目】为进一步认识氧气,老师请你一起参加实验室制取氧气的实践和研究。
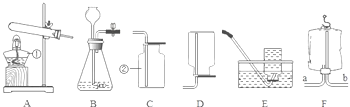
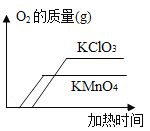
(1)实验室用A制取氧气的化学方程式为_____,收集氧气可选用E装置,理由是____.收集完气体后,测得氧气纯度明显偏低,原因可能是______(填序号).
A.高锰酸钾中混入了二氧化锰 B.收集前,集气瓶中未注满水
C.收集后,集气瓶中仍有少量水 D.未见气泡连续均匀冒出时就开始收集
(2)现准备收集氧气供铁丝、硫燃烧的实验使用,选择__(填装置序号)装置收集氧气便于直接做实验。
(3)某同学利用空塑料输液袋(如图F)收集氧气,验满氧气时,把带火星的木条放在玻璃管__(填“a”或“b”)端,若复燃则收集满了.
(4)乙炔是一种微溶于水的气体,密度与空气接近,实验室常用块状电石和水在常温下反应制取乙炔.制取乙炔的发生装置为___(填装置序号).
(5)拓展延伸:小亮同学在制取氧气的实验过程中,不小心把硫酸铜溶液滴加到了盛有5%的过氧化氢溶液中,立即产生大量气泡,于是引起了小亮同学的探究兴趣.
(提出问题)是哪种粒子能使过氧化氢分解的速率加快呢?
(查阅资料)稀硫酸中含有的粒子(H2O、H +、SO42-); CuSO4溶液主要含有三种粒子(H2O、Cu2+、SO42-),为了进一步探究CuSO4溶液中哪种粒子能起催化作用。小明同学作了以下分析和设计。
(猜想与假设)
Ⅰ、小亮同学认为不可能是H2O,理由是____;
Ⅱ、可能是SO42-;Ⅲ、可能是Cu2+.
(实验验证)
实验步骤 | 实验现象 | 结论 |
a.取一支试管加入5mL5%过氧化氢溶液,然后加入2﹣3滴稀硫酸 | 溶液几乎没有气泡放出 | ___不能使过氧化氢分解速率加快。 |
b.另取一支试管加入5mL5%过氧化氢溶液,然后加入2﹣3滴CuSO4溶液 | 溶液中有大量气泡放出 |
结论;实验证明,使过氧化氢分解速率加快的是_________。
(反思与交流)
Ⅰ、如果要证明硫酸铜是催化剂,还需要证明______。
Ⅱ、已知氧化铜也能做该反应的催化剂,现在把8克硫酸铜改为氧化铜,要使其铜元素质量相等,则需要氧化铜的质量是多少______?请列式计算。