题目内容
金属用途广泛,其结构和性质等是化学的重要研究内容。
(1)如图是铝的原子结构示意图。下列说法不正确的是_______。

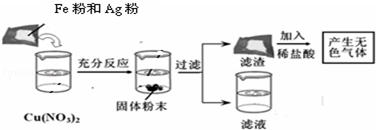
(2)某化学小组用一定量的AgNO3和Cu(NO3)2混合溶液进行了如图实验,并对溶液A和固体B的成分进行了分析和研究。

【提出问题】溶液A中的溶质可能有哪些?
【做出猜想】
① 只有Zn(NO3)2 ② Zn(NO3)2、AgNO3
③ Zn(NO3)2、Cu(NO3)2 ④ Zn(NO3)2、Cu(NO3)2、AgNO3
【交流讨论】不合理的猜想是_______(填标号),其理由是_______。
【实验探究】若猜想①成立,通过以下实验可确定固体B的成分,请将下表填写完整。
(3)新型材料纳米级 Fe 粉具有广泛的用途,它比普通 Fe 粉更易与氧气反应,其制备工艺流程如图所示:

请回答下列问题:
①纳米级Fe粉在空气中易自燃。实验中通入N2的目的是_______。
②写出H2还原FeCl2,置换出铁的化学方程式_______。
③研究人员发现最后制得的纳米级 Fe 粉样品中混有少量的 FeCl2杂质。取样品20g,加入足量的盐酸,生成氢气 0.7 g。请计算该样品中单质 Fe 的质量分数(请写出计算过程)。_______
(1)如图是铝的原子结构示意图。下列说法不正确的是_______。

| A.铝原子中的质子数为13 |
| B.在化合物中铝通常显+3价 |
| C.铝是地壳中含量最多的元素 |
| D.铝可作导线是由于它具有良好的导电性 |

【提出问题】溶液A中的溶质可能有哪些?
【做出猜想】
① 只有Zn(NO3)2 ② Zn(NO3)2、AgNO3
③ Zn(NO3)2、Cu(NO3)2 ④ Zn(NO3)2、Cu(NO3)2、AgNO3
【交流讨论】不合理的猜想是_______(填标号),其理由是_______。
【实验探究】若猜想①成立,通过以下实验可确定固体B的成分,请将下表填写完整。
| 实验步骤 | 现象 | 实验结论 |
| 取少量固体B,滴加_______ | 有气泡产生 | 固体B含有Cu 、Ag和_ |
(3)新型材料纳米级 Fe 粉具有广泛的用途,它比普通 Fe 粉更易与氧气反应,其制备工艺流程如图所示:

请回答下列问题:
①纳米级Fe粉在空气中易自燃。实验中通入N2的目的是_______。
②写出H2还原FeCl2,置换出铁的化学方程式_______。
③研究人员发现最后制得的纳米级 Fe 粉样品中混有少量的 FeCl2杂质。取样品20g,加入足量的盐酸,生成氢气 0.7 g。请计算该样品中单质 Fe 的质量分数(请写出计算过程)。_______
(1)C
(2)② Zn应先与AgNO3反应,后与Cu(NO3)2反应,当有AgNO3剩余时,溶质中一定含有Cu(NO3)2
| 实验步骤 | 现象 | 实验结论 |
| 稀盐酸(或稀硫酸等) | | Zn |
(3)①防止生成的纳米级铁粉被氧化;②H2+FeCl2
 Fe+2HCl。③98%
Fe+2HCl。③98%试题分析:
⑴原子结构示意图中,圆圈内的数字表示质子数,A正确。铝原子最外层电子数为3,反应中易失去最外层电子,故化学价通常显+3价,B正确。铝是地壳中含量最多的金属元素,C错误。铝具有较好的导电性,故可作电线,D正确。
⑵Zn加入到AgNO3和Cu(NO3)2混合溶液中,首先与硝酸银反应,当硝酸银反应消失后,剩余的锌再与硝酸铜反应,如果硝酸铜都反应没了,锌剩余。根据以上事实,我们可以得出这样一个结论:硝酸银、硝酸铜按先后顺序被反应掉。故猜想②不正确,在有硝酸银的情况下,硝酸铜还没参与反应,一定也存在。若溶液中只有硝酸锌,则表明锌已将硝酸银、硝酸铜全部反应掉了,此时锌还可能有剩余。检测方法是加入稀酸,因为锌为活泼金属,加入稀酸必产生气泡。
⑶①通过题目信息,容易理解通入氮气目的是隔绝氧气,以防发生燃烧反应。
③先根据氢气质量求算出铁的质量,再将它除以样品质量即得单质铁的质量分数。具体过程如下:
解:设Fe的质量为x
Fe + 2HCl=FeCl2 + H2↑
56 2
x 0.7g

x="19.6g"
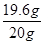 ×100%= 98%
×100%= 98%答:该样品中单质铁的质量分数为98%

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目